مستخدم:Mohammed Qays/ملعب3
| Mohammed Qays/ملعب3 | |
|---|---|
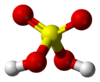 S=O bond length = 142.2 pm, S-O bond length = 157.4 pm, O-H bond length = 97 pm |
 |
| الاسم النظامي (IUPAC) | |
Sulfuric acid |
|
| أسماء أخرى | |
|
|
| المعرفات | |
| رقم CAS | 7664-93-9 |
| بوب كيم (PubChem) | 1118 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | H2SO4, sometimes expressed (HO)2SO2 |
| الكتلة المولية | 98.079 g/mol |
| المظهر | Colorless viscous liquid |
| الرائحة | Odorless |
| الكثافة | 1.8302 g/cm3, liquid[1] |
| نقطة الانصهار | 10.31[1] °س، خطأ في التعبير: علامة ترقيم لم نتعرف عليها «». °ك، خطأ في التعبير: علامة ترقيم لم نتعرف عليها «». °ف |
| نقطة الغليان | 337[1] °س، خطأ في التعبير: علامة ترقيم لم نتعرف عليها «». °ك، خطأ في التعبير: علامة ترقيم لم نتعرف عليها «». °ف |
| الذوبانية في الماء | miscible, exothermic |
| ضغط البخار | 0.001 mmHg (20 °C)[2] |
| حموضة (pKa) | pKa1 = −2.8 pKa2 = 1.99 |
| اللزوجة | 26.7 بواز (20 °C) |
| البنية | |
| البنية البلورية | monoclinic |
| زمرة فراغية | C2/c |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−814 kJ/mol[3] |
| إنتروبيا مولية قياسية S |
157 J/(mol·K)[3] |
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | Danger |
| بيانات الخطر وفق GHS | H314 |
| بيانات وقائية وفق GHS | P260, P264, P280, P301+330+331, P303+361+353, P363, P304+340, P305+351+338, P310, P321, P405, P501 |
| NFPA 704 |
|
| نقطة الوميض | Non-flammable |
| حد التعرض المسموح به U.S | TWA 1 mg/m3[2] |
| 15 mg/m3 (IDLH) 1 mg/m3 (TWA) 2 mg/m3 (STEL) |
|
| LD50 | 2140 mg/kg (rat, oral)[4] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض الكبريتيك ( التهجئة الأمريكية والاسم المفضل للاتحاد الدولي للكيمياء البحتة والتطبيقية ) أو حمض الكبريتيك ( تهجئة الكومنولث )، المعروف في العصور القديمة باسم زيت الزاج، هو حمض معدني يتكون من عناصر الكبريت والأكسجين والهيدروجين، وله الصيغة الجزيئية.H2SO4.وهو سائل لزج عديم اللون والرائحة، يمتزج مع الماء. [5]
لا يتواجد حمض الكبريتيك النقي بشكل طبيعي بسبب قابليته القوية لبخار الماء ؛ فهو استرطابي ويمتص بخار الماء من الهواء بسهولة. [5] حمض الكبريتيك المركز يسبب تآكلًا شديدًا للمواد الأخرى، من الصخور إلى المعادن، لأنه مادة مؤكسدة ذات خصائص تجفيف قوية. يعد خامس أكسيد الفوسفور استثناءً ملحوظًا لأنه لا يتم تجفيفه بواسطة حمض الكبريتيك، بل على العكس من ذلك، يجفف حمض الكبريتيك إلى ثالث أكسيد الكبريت.عند إضافة حمض الكبريتيك إلى الماء، يتم إطلاق كمية كبيرة من الحرارة؛ وبالتالي، لا ينبغي تنفيذ الإجراء العكسي لإضافة الماء إلى الحمض لأن الحرارة المنبعثة قد تؤدي إلى غليان المحلول، مما يؤدي إلى رش قطرات من الحمض الساخن أثناء العملية. عند ملامسة أنسجة الجسم، يمكن أن يسبب حمض الكبريتيك حروقًا كيميائية حمضية شديدة وحتى حروقًا حرارية ثانوية بسبب الجفاف. [6] [7] يعتبر حمض الكبريتيك المخفف أقل خطورة إلى حد كبير بدون خصائصه المؤكسدة والمجففة؛ ومع ذلك، لا يزال ينبغي التعامل معه بحذر بسبب حموضته.
يعد حمض الكبريتيك مادة كيميائية سلعية مهمة جدًا؛ يعد إنتاجحمض الكبريتيك في بلد ما مؤشرا جيدا على قوتها الصناعية. [8] ومن المعروف أن العديد من الطرق لإنتاجه، بما في ذلك عملية الاتصال، وعمليةحمض الكبريتيك الرطب، وعملية غرفة الرصاص.[9] حمض الكبريتيك هو أيضا مادة أساسية في الصناعة الكيميائية.وهو الأكثر استخدامًا في صناعة الأسمدة [10] ولكنه مهم أيضًا في معالجة المعادن وتكرير النفط ومعالجة مياه الصرف الصحي والتخليق الكيميائي.وله مجموعة واسعة من التطبيقات النهائية، بما في ذلك في منظفات الصرف الحمضية المنزلية، [11] كمحلول كهربائي في بطاريات الرصاص الحمضية، كمركب تجفيف، وفي عوامل التنظيف المختلفة. يمكن الحصول على حمض الكبريتيك عن طريق إذابة ثالث أكسيد الكبريت في الماء.
الخصائص الفيزيائية
عدلدرجات حمض الكبريتيك
عدلعلى الرغم من أنه يمكن صنع ما يقرب من 100% من محاليل حمض الكبريتيك، إلا أن الفقد اللاحق لـSO3 عند نقطة الغليان يصل التركيز إلى 98.3% حمض. أما درجة 98.3%، وهي الأكثر استقرارًا في التخزين، فهي الشكل المعتاد لما يوصف بـ "حمض الكبريتيك المركز". وتستخدم تركيزات أخرى لأغراض مختلفة. بعض التركيزات الشائعة هي:[12][13]
| جزء الشامل </br>H2SO4 |
كثافة </br> (كجم / لتر) |
تركيز </br> (مول/لتر) |
اسم شائع |
|---|---|---|---|
| <29% | 1.00-1.25 | <4.2 | حمض الكبريتيك المخفف |
| 29-32% | 1.25-1.28 | 4.2-5.0 | حمض البطارية </br> (تستخدم في بطاريات الرصاص الحمضية ) |
| 62-70% | 1.52-1.60 | 9.6-11.5 | حمض الغرفة </br> حمض الأسمدة |
| 78-80% | 1.70-1.73 | 13.5-14.0 | حمض البرج </br> حمض جلوفر |
| 93.2% | 1.83 | 17.4 | 66 درجة حمض بي ("66 درجة بوميه"). |
| 98.3% | 1.84 | 18.4 | حامض الكبريتيك المركز |
"حمض الغرفة" و"حمض البرج" هما تركيزا حمض الكبريتيك الناتجين عن عملية غرفة الرصاص، وحمض الغرفة هو الحمض المنتج في غرفة الرصاص نفسها (<70% لتجنب التلوث بحمض النيتروسيل سلفوريك ) وحمض البرج هو تم استخراج الحمض من قاع برج جلوفر. [12] [13] وقد عفا عليها الزمن الآن كتركيزات تجارية لحمض الكبريتيك، على الرغم من أنه يمكن تحضيرها في المختبر من حمض الكبريتيك المركز إذا لزم الأمر. على وجه الخصوص، يتم تحضير حمض الكبريتيك "10 م" (المعادل الحديث لحمض الحجرة، المستخدم في العديد من عمليات المعايرة )، عن طريق إضافة حمض الكبريتيك بنسبة 98% ببطء إلى حجم متساوٍ من الماء، مع التحريك الجيد:يمكن أن ترتفع درجة حرارة الخليط. إلى 80 درجة مئوية (176 درجة فهرنهايت) أو أعلى. [13]
حمض الكبريتيك
عدلحمض الكبريتيك لا يحتوي فقطH2SO4، ولكنها في الواقع توازن للعديد من الأنواع الكيميائية الأخرى، كما هو موضح في الجدول أدناه.
| صِنف | ملي مول/كجم |
|---|---|
| 15.0 | |
| 11.3 | |
| 8.0 | |
| 4.4 | |
| 3.6 | |
| 0.1 |
حمض الكبريتيك هو سائل زيتي عديم اللون، ويبلغ ضغط بخاره أقل من 0.001 مم زئبق عند درجة حرارة 25. درجة مئوية و1 ملم زئبق عند 145.8 درجة مئوية، [15] و98% من حمض الكبريتيك لديه ضغط بخار أقل من 1 مم زئبق عند 40 درجة مئوية. [16]
في الحالة الصلبة، حمض الكبريتيك هو مادة صلبة جزيئية تشكل بلورات أحادية الميل ذات معاملات شبكية مثلثية تقريبًا. ويتكون الهيكل من طبقات موازية للمستوى (010)، حيث يرتبط كل جزيء بجزئين آخرين بواسطة روابط هيدروجينية. هيدراتH2SO4·nH2O معروفة بـ n = 1، 2، 3، 4، 6.5، و8، على الرغم من أن معظم الهيدرات المتوسطة مستقرة ضد عدم التناسب.[17]
القطبية والموصلية
عدلحمض الكبريتيك اللا مائي هو سائل قطبي للغاية، وله ثابت عازل يبلغ حوالي 100. لديه موصلية كهربائية عالية، نتيجة للتحلل الذاتي، أي البروتون الذاتي :[14]
- H2SO4 ⇌ H3SO+4 + HSO−4
ثابت التوازن للتحلل الذاتي (25 درجة مئوية) هو:[14]
- [H3SO4]+[HSO4]− = 2.7 × 10−4
ثابت التوازن للماء [الإنجليزية] K w هو 10 −14 بعامل 10 10 (10 مليار) أصغر.
على الرغم من لزوجة الحمض، فإن التوصيلات [الإنجليزية] الفعالة للحمضH3SO+4 وHSO−4تكون أيونات عالية بسبب آلية تبديل البروتون داخل الجزيئات (مماثلة لآلية جروثوس في الماء)، مما يجعل حمض الكبريتيك موصلًا جيدًا للكهرباء. وهو أيضًا مذيب ممتاز للعديد من التفاعلات.
الخواص الكيميائية
عدلحموضة
عدلتفاعل ترطيب حمض الكبريتيك طارد للحرارة للغاية، مخفف. [18]
كما يتضح من ثابت تفكك الحمض، فإن حمض الكبريتيك هو حمض قوي:
- H2SO4 → H3O+ + HSO−4 Ka1 = 1000 (pKa1 = −3)
منتج هذا التأين هوHSO−4، أنيون ثنائي الكبريتات، وهو حمض أضعف بكثير:
- HSO−4 + H2O → H3O+ + SO2−4 Ka2 = 0.01 (pKa2 = 2) [19]
نتاج هذا التفكك الثاني هوSO2−4، أنيون الكبريتات .
تجفيف
عدليتمتع حمض الكبريتيك المركز بخاصية تجفيف قوية، حيث يزيل الماء (H2O ) من مركبات كيميائية أخرى مثل سكر المائدة (السكروز) والكربوهيدرات الأخرى لإنتاج الكربون والبخار والحرارة. يعد تجفيف سكر المائدة (السكروز) عرضًا مختبريًا شائعًا.[20] يصبح السكر داكنًا مع تشكل الكربون، وقد يظهر عمود صلب من الكربون الأسود المسامي يسمى ثعبان الكربون [الإنجليزية][21] كما هو موضح في الشكل.
وبالمثل، فإن خلط النشا معحمض الكبريتيك المركز يعطي الكربون الأولي والماء. ويمكن ملاحظة تأثير ذلك عند انسكاب حمض الكبريتيك المركز على الورق، والذي يتكون من السليلوز ؛ يتفاعل السليلوز ليعطي مظهرًا محترقًا حيث يبدو الكربون مشابهًا إلى حد كبير للسخام الناتج عن النار. على الرغم من أنه أقل إثارة، إلا أن تأثير الحمض على القطن، حتى في شكل مخفف، يدمر القماش.
يمكن أن يوضح التفاعل مع كبريتات النحاس الثنائي، وأيضًا خاصية الجفاف لحمض الكبريتيك. تتحول البلورات الزرقاء إلى مسحوق أبيض عند إزالة الماء:
التفاعل مع الأملاح
عدليتفاعل حمض الكبريتيك مع معظم القواعد ليعطي الكبريتات أو ثنائي الكبريتات المقابلة.
يتفاعل حمض الكبريتيك مع كلوريد الصوديوم وينتج غاز كلوريد الهيدروجين وثنائي كبريتات الصوديوم:
- NaCl + H2SO4 → NaHSO4 + HCl
كبريتات الألومنيوم، تصنع عن طريق معالجة البوكسيت مع حمض الكبريتيك:
- 2 AlO(OH) + 3 H2SO4 → Al2(SO4)3 + 4 H2O
يمكن أيضًا استخدام حمض الكبريتيك لإزاحة الأحماض الأضعف من أملاحها. مثلاً التفاعل مع خلات الصوديوم، يزيح حمض الأسيتيك ،CH3COOH، ويشكل ثنائي كبريتات الصوديوم:
- H2SO4 + CH3CO2Na → NaHSO4 + CH3COOH
وبالمثل، فإن معالجة نترات البوتاسيوم بحمض الكبريتيك ينتج عنها حمض النيتريك.
عند دمجه مع حمض النيتريك، يعمل حمض الكبريتيك كحمض وعامل تجفيف، مما يؤدي إلى تكوين أيون النيترونيوم [الإنجليزية] NO+2، وهو مهم في تفاعلات النترتة التي تتضمن الاستبدال العطري الكهربي.هذا النوع من التفاعل، حيث يحدث البروتون على ذرة الأكسجين، مهم في العديد من تفاعلات الكيمياء العضوية، مثل أسترة فيشر وتجفيف الكحولات.
عندما يسمح له بالتفاعل مع الأحماض الفائقة، يمكن أن يعمل حمض الكبريتيك كقاعدة ويمكن بروتونته، مكونًا[H3SO4]+ أيون. أملاح[H3SO4]+تم تحضير (مثل ثلاثي هيدروكسي أوكسوسلفونيوم سداسي فلورو أنتيمونات (V)[H3SO4]+[SbF6]− ) باستخدام التفاعل التالي في السائل HF :
- [(CH3)3SiO]2SO2 + 3 HF + SbF5 → [H3SO4]+[SbF6]− + 2 (CH3)3SiF
التفاعل المذكور أعلاه مفضل من الناحية الديناميكية الحرارية بسبب التفكك الحراري العالي للرابطة Si-F في المنتج الجانبي. ومع ذلك، فقد باءت عملية البروتون باستخدام حمض الفلوروأنتيمونيك بالفشل، حيث يخضع حمض الكبريتيك النقي للتأين الذاتي ليعطي[H3O]+ الأيونات:
- 2 H2SO4 ⇌ H3O+ + HS2O−7
مما يمنع تحويلH2SO4 ل[H3SO4]+ بواسطة HF/SbF5نظام [22]
التفاعل مع المعادن
عدلحتى حمض الكبريتيك المخفف يتفاعل مع العديد من المعادن عبر تفاعل إزاحة واحد، مثل الأحماض النموذجية الأخرى، منتجًا غاز الهيدروجين والأملاح (كبريتات المعدن). إنه يهاجم المعادن التفاعلية (المعادن الموجودة في مواضع أعلى من النحاس في سلسلة التفاعل ) مثل الحديد والألومنيوم والزنك والمنجنيز والمغنيسيوم والنيكل .
- Fe + H2SO4 → H2 + FeSO4
يمكن أن يعمل حمض الكبريتيك المركز كعامل مؤكسد، حيث يطلق ثاني أكسيد الكبريت:[6]
- Cu + 2 H2SO4 → SO2 + 2 H2O + SO2−4 + Cu2+
ومع ذلك، فإن الرصاص والتنغستن مقاومان لحمض الكبريتيك.
التفاعلات مع الكربون والكبريت
عدليعمل حمض الكبريتيك المركز الساخن على أكسدة الكربون[23] (على شكل فحم قاري ) والكبريت:
- C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
- S + 2 H2SO4 → 3 SO2 + 2 H2O
الاستبدال العطري الكهربي
عدليخضع البنزين لاستبدال عطري إلكتروفيلي بحمض الكبريتيك ليعطي أحماض السلفونيك المقابلة:[24]
دورة الكبريت واليود
عدليمكن استخدام حمض الكبريتيك لإنتاج الهيدروجين من الماء :
| 2 I2 + 2 SO2 + 4 H2O → 4 HI + 2 H2SO4 | (120 °C، تفاعل بنسن [الإنجليزية]) |
| 2 H2SO4 → 2 SO2 + 2 H2O + O2 | (830 °C) |
| 4 HI → 2 I2 + 2 H2 | (320 °C) |
يتم استرداد مركبات الكبريت واليود وإعادة استخدامها، ومن هنا تسمى العملية دورة الكبريت واليود.هذه العملية ماصة للحرارة ويجب أن تحدث عند درجات حرارة عالية، لذلك يجب توفير الطاقة على شكل حرارة. تم اقتراح دورة الكبريت واليود كوسيلة لتزويد الهيدروجين للاقتصاد المعتمد على الهيدروجين.وهو بديل للتحليل الكهربائي، ولا يتطلب استخدام الهيدروكربونات مثل الطرق الحالية للإصلاح بالبخار.لكن لاحظ أن كل الطاقة المتوفرة في الهيدروجين المنتج يتم توفيرها بواسطة الحرارة المستخدمة في تصنيعه. [25] [26]
حالة
عدلنادرًا ما يوجد حمض الكبريتيك بشكل طبيعي على الأرض في صورة لا مائي، وذلك بسبب قابليته الكبيرة للماء.حمض الكبريتيك المخفف هو أحد مكونات المطر الحمضي، الذي يتكون من أكسدة ثاني أكسيد الكبريت في الغلاف الجوي في وجود الماء - أي أكسدة حمض الكبريتيك.عندما يتم حرق الوقود المحتوي على الكبريت مثل الفحم أو النفط، فإن ثاني أكسيد الكبريت هو المنتج الثانوي الرئيسي (إلى جانب المنتجات الرئيسية أكاسيد الكربون والماء).
يتكون حمض الكبريتيك بشكل طبيعي من أكسدة معادن الكبريتيد، مثل البيريت:
- 2 FeS2(s) + 7 O2 + 2 H2O → 2 Fe2+ + 4 SO2−4 + 4 H+
ويطلق على المياه شديدة الحموضة الناتجة تصريف المناجم الحمضية (AMD) أو تصريف الصخور الحمضية (ARD).
الFe2+يمكن أكسدة بشكل أكبرFe3+ :
- 4 Fe2+ + O2 + 4 H+ → 4 Fe3+ + 2 H2O
الFe3+يمكن ترسيب الناتج في صورة هيدروكسيد أو أكسيد الحديد المائي:
- Fe3+ + 3 H2O → Fe(OH)3↓ + 3 H+
يمكن لأيون الحديد (III) ("الحديديك") أيضًا أكسدة البيريت:
- FeS2(s) + 14 Fe3+ + 8 H2O → 15 Fe2+ + 2 SO2−4 + 16 H+
عندما تحدث أكسدة الحديد (III) للبيريت، يمكن أن تصبح العملية سريعة. تم قياس قيم الرقم الهيدروجيني أقل من الصفر في ARD الناتج عن هذه العملية.
يمكن أن تنتج ARD أيضًا حمض الكبريتيك بمعدل أبطأ، بحيث يمكن لقدرة تحييد الحمض (ANC) لطبقة المياه الجوفية أن تحيد الحمض المنتج. في مثل هذه الحالات، يمكن زيادة تركيز المواد الصلبة الذائبة الكلية (TDS) في الماء من خلال إذابة المعادن من تفاعل تحييد الحمض مع المعادن.
يستخدم حمض الكبريتيك كوسيلة دفاع من قبل بعض الأنواع البحرية، على سبيل المثال، تقوم طحالب phaeophyte alga Desmarestia munda (رتبة Desmarestiales ) بتركيز حمض الكبريتيك في فجوات الخلية. [27]
الهباء الجوير الستراتوسفير
عدلفي الستراتوسفير، الطبقة الثانية من الغلاف الجوي والتي تتراوح بشكل عام بين 10 و50 كيلومتراً فوق سطح الأرض، يتكون حمض الكبريتيك من أكسدة ثاني أكسيد الكبريت البركاني بواسطة جذري الهيدروكسيل:[28]
- SO2 + HO• → HSO3
- HSO3 + O2 → SO3 + HO2
- SO3 + H2O → H2SO4
نظرًا لأن حمض الكبريتيك يصل إلى درجة التشبع الفائق في طبقة الستراتوسفير، فإنه يمكن أن ينوي جزيئات الهباء الجوي ويوفر سطحًا لنمو الهباء الجوي عن طريق التكثيف والتخثر مع هباء حمض الكبريتيك المائي الآخر. وينتج عن ذلك طبقة الهباء الجوي الستراتوسفيري.[28]
حمض الكبريتيك خارج كوكب الأرض
عدلتنتج السحب الزهرية الدائمة أمطارًا حمضية مركزة، كما تنتج السحب الموجودة في الغلاف الجوي للأرض أمطارًا مائية.[29] ويُعتقد أيضًا أن قمر المشتري "أوروبا" يمتلك غلافًا جويًا يحتوي على هيدرات حمض الكبريتيك.[30]
التصنيع
عدليُنتج حمض الكبريتيك من الكبريت والأكسجين والماء عبر عملية التلامس التقليدية (DCDA) أو عملية حمض الكبريتيك الرطب (WSA).
عملية التلامس
عدلفي الخطوة الأولى، يُحرق الكبريت لإنتاج ثاني أكسيد الكبريت.
- S(s) + O2 → SO2
ويتأكسد ثاني أكسيد الكبريت إلى ثالث أكسيد الكبريت بواسطة الأكسجين في وجود محفز أكسيد الفاناديوم الخماسي. وهو تفاعل عكسي.
- 2 SO2 + O2 ⇌ 2 SO3
يمتص ثلاثي أكسيد الكبريت إلى 97-98%H2SO4 لتكوين الزيت (H2S2O7 )، المعروف أيضًا باسم حمض الكبريتيك المدخن أو حمض البيروكبرتيك. ثم يُخفف الأوليوم بالماء لتكوين حمض الكبريتيك المركز.
- H2SO4 + SO3 → H2S2O7
- H2S2O7 + H2O → 2 H2SO4
الذوبان مباشرة SO3 نادرًا ما تتم ممارسة الكبريت في الماء، والتي تسمى " عملية حمض الكبريتيك الرطب "، لأن التفاعل طارد للحرارة للغاية، مما يؤدي إلى هباء ساخن من حمض الكبريتيك يتطلب التكثيف والفصل.
عمليةحمض الكبريتيك الرطب
عدلفي الخطوة الأولى، يُحرق الكبريت لإنتاج ثاني أكسيد الكبريت:
- S + O2 → SO2 (−297 kJ/mol)
أو، بدلا من ذلك، كبريتيد الهيدروجين (H2S) يحرق غاز SO2:
- 2 H2S + 3 O2 → 2 H2O + 2 SO2 (−1036 kJ/mol)
ثم يتأكسد ثاني أكسيد الكبريت إلى ثلاثي أكسيد الكبريت باستخدام الأكسجين مع أكسيد الفاناديوم الخماسي كمحفز.
- 2 SO2 + O2 ⇌ 2 SO3 (−198 kJ/mol) (تفاعل عكسي)
يتم ترطيب ثالث أكسيد الكبريت إلى حمض الكبريتيكH2SO4 :
- SO3 + H2O → H2SO4(g) (−101 kJ/mol)
الخطوة الأخيرة هي تكثيف حمض الكبريتيك إلى سائل 97-98%H2SO4 :
- H2SO4(g) → H2SO4(l) (−69 kJ/mol)
أساليب أخرى
عدلالطريقة الأقل شهرة هي طريقة الميتابيسلفيت، حيث يتم وضع الميتابيسلفيت في قاع الكأس ويضاف إليه حمض الهيدروكلوريك بتركيز 12.6 مولي. يتم ضخ الغاز الناتج من خلال حمض النيتريك، والذي سيطلق أبخرة بنية/حمراء من ثاني أكسيد النيتروجين مع استمرار التفاعل. تتم الإشارة إلى اكتمال التفاعل من خلال توقف الأبخرة. لا تنتج هذه الطريقة ضبابًا لا ينفصل، وهو أمر مريح تمامًا.
- 3 SO2 + 2 HNO3 + 2 H2O → 3 H2SO4 + 2 NO
حرق الكبريت مع الملح الصخري ( نترات البوتاسيوم ,KNO3تم استخدام ) في وجود البخار تاريخياً. عندما يتحلل الملح الصخري، فإنه يتأكسد الكبريت إلىSO3 الذي يتحد مع الماء لينتج حمض الكبريتيك.
بدلًا من ذلك، يمكن إذابة ثاني أكسيد الكبريت في محلول مائي من ملح فلز مؤكسد مثل كلوريد النحاس (II) أو كلوريد الحديد (III):
- 2 FeCl3 + 2 H2O + SO2 → 2 FeCl2 + H2SO4 + 2 HCl
- 2 CuCl2 + 2 H2O + SO2 → 2 CuCl + H2SO4 + 2 HCl
طريقتان معمليتان أقل شهرة لإنتاج حمض الكبريتيك، وإن كانا في صورة مخففة ويتطلبان بعض الجهد الإضافي في التنقية. يمكن تحليل محلول كبريتات النحاس الثنائي كهربائيًا باستخدام كاثود النحاس وأنود البلاتين/الجرافيت ليعطي نحاسًا إسفنجيًا عند الكاثود وتطور غاز الأكسجين عند الأنود، ويشير محلول حمض الكبريتيك المخفف إلى اكتمال التفاعل عندما يتحول من اللون الأزرق واضح (إنتاج الهيدروجين عند الكاثود علامة أخرى):
- 2 CuSO4 + 2 H2O → 2 Cu + 2 H2SO4 + O2
الأكثر تكلفة وخطورة وإزعاجًا هي طريقة البروم الكهربي، والتي تستخدم خليطًا من الكبريت والماء وحمض الهيدروبروميك كمحلول إلكتروليتي. يتم دفع الكبريت إلى قاع الحاوية تحت المحلول الحمضي. ثم يتم استخدام الكاثود النحاسي وأنود البلاتين/الجرافيت مع الكاثود بالقرب من السطح ويتم وضع الأنود في الجزء السفلي من المنحل بالكهرباء لتطبيق التيار. قد يستغرق ذلك وقتًا أطول وينبعث منه أبخرة سامة من البروم /بروميد الكبريت، لكن الحمض المتفاعل قابل لإعادة التدوير. بشكل عام، يتم تحويل الكبريت والماء فقط إلى حمض الكبريتيك والهيدروجين (مع حذف فقدان الحمض كأبخرة):
- 2 HBr → H2 + Br2 (electrolysis of aqueous hydrogen bromide)
- Br2 + Br− ↔ Br−3 (initial tribromide production, eventually reverses as Br− depletes)
- 2 S + Br2 → S2Br2 (bromine reacts with sulfur to form disulfur dibromide)
- S2Br2 + 8 H2O + 5 Br2 → 2 H2SO4 + 12 HBr (oxidation and hydration of disulfur dibromide)
قبل عام 1900، تم تصنيع معظم حمض الكبريتيك عن طريق عملية غرفة الرصاص.[31] في أواخر عام 1940، تم إنتاج ما يصل إلى 50% من حمض الكبريتيك المُصنّع في الولايات المتحدة بواسطة مصانع معالجة الغرفة.
في أوائل القرن التاسع عشر وحتى منتصفه، كانت نباتات "الزاج" موجودة، من بين أماكن أخرى، في بريستونبانس في اسكتلندا، وشروبشاير ووادي لاغان [الإنجليزية] في مقاطعة أنتريم بأيرلندا، حيث تم استخدامها كمبيض للكتان. تم إجراء التبييض المبكر للكتان باستخدام حمض اللاكتيك من اللبن الرائب، لكن هذه كانت عملية بطيئة، كما أدى استخدام الزاج إلى تسريع عملية التبييض. [32]
تاريخ
عدلالزاج
عدلالتاريخ القديم
عدلبدأت دراسة الزاج ( الكبريتات المائية للمعادن المختلفة التي تشكل معادن زجاجية يمكن استخلاص حمض الكبريتيك منها) في العصور القديمة.كان لدى السومريين قائمة بأنواع الزاج التي صنفوها حسب لون المادة. بعض المناقشات المبكرة حول أصل وخصائص الزاج موجودة في أعمال الطبيب اليوناني ديوسقوريدس (القرن الأول الميلادي) وعالم الطبيعة الروماني بليني الأكبر (23-79 م). ناقش جالينوس أيضًا استخدامه الطبي. تم تسجيل الاستخدامات المعدنية للمواد اللاذعة في الأعمال الكيميائية الهلنستية لزوسيموس البانوبوليس، وفي أطروحة Phisica et Mystica، وبردية Leyden X.[33]
جابر بن حيان، أبو بكر الرازي، ابن سينا، وآخرون.
عدلالكيميائيون الإسلاميون في العصور الوسطى مثل المؤلفين الذين يكتبون تحت اسم جابر بن حيان (توفي حوالي 806 - 816 م)، وأبو بكر الرازي (865 - 925 م)، أدرج ابن سينا (980 – 1037 م)، ومحمد بن إبراهيم الوطواط (1234 – 1318 م) الزاج في قوائم تصنيف المعادن الخاصة بهم. [34]
قام المؤلفان جابر والرازي بإجراء تجارب مكثفة على تقطير المواد المختلفة، بما في ذلك الزاج. [35] وفي إحدى الوصفات المسجلة في كتاب الأسرار Kitāb al-Asrār ربما يكون الرازي قد صنع حمض الكبريتيك دون أن يعلم بذلك:[36]
في عمل لاتيني مجهول يُنسب بشكل مختلف إلى أرسطو (تحت عنوان Liber Aristotilis</link>، 'كتاب أرسطو')، [38] للرازي (تحت عنوان Lumen luminum magnum</link> "نور الأنوار العظيم")، أو لابن سينا، [39] يتحدث المؤلف عن "زيت" ( oleum )</link> ) تم الحصول عليه من خلال تقطير كبريتات الحديد (II) (الزاج الأخضر)، والذي كان على الأرجح "زيت الزاج" أو حمض الكبريتيك. [40] يشير العمل عدة مرات إلى كتاب السبعين لجابر بن حيان ( Liber de septuaginta</link> )، أحد أعمال جابر العربية القليلة التي تُرجمت إلى اللاتينية. [41] يشير مؤلف النسخة المنسوبة إلى الرازي أيضًا إلى Liber de septuaginta</link> كعمل خاص به، مما يدل على أنه يعتقد خطأً في Liber de septuaginta</link> ليكون من أعمال الرازي. [42] هناك عدة دلائل تشير إلى أن العمل المجهول كان تكوينًا أصليًا باللغة اللاتينية، [43] على الرغم من أنه وفقًا لإحدى المخطوطات تمت ترجمته بواسطة ريموند مرسيليا، مما يعني أنه ربما كان أيضًا ترجمة من العربية. [44]
بالنسبة الى أحمد يوسف الحسن، ثلاث وصفات لحمض الكبريتيك موجودة في مخطوطة كرشوني مجهولة المصدر تحتوي على مجموعة مأخوذة من عدة مؤلفين ويعود تاريخها إلى ما قبل ق. 1100 AD.[45] واحد منهم يعمل على النحو التالي:
ماء الزاج والكبريت الذي يستعمل في سقي الأدوية:الزاج الأصفر ثلاثة أجزاء، والكبريت الأصفر جزء واحد، يطحنهما ويقطرهما على طريقة ماء الورد. [46]
تم ذكر وصفة لتحضيرحمض الكبريتيك في Risālat Jaʿfar al-Sādiq fī ʿilm al-ṣanʿa، وهي رسالة عربية منسوبة خطأً إلى الإمام الشيعي جعفر الصادق (توفي 765). قام يوليوس روسكا بتأريخ هذه الرسالة إلى القرن الثالث عشر، ولكن وفقًا لأحمد يوسف الحسن فمن المحتمل أن يعود تاريخها إلى فترة سابقة:[47]
ثم قم بتقطير الزاج الأخضر في القرعيات والأنبيق باستخدام نار متوسطة. خذ ما تحصل عليه من نواتج التقطير، وستجده صافيًا ذا صبغة خضراء. [46]
فنسنت بوفيه، وألبرتوس ماغنوس، وجبر الزائف
عدلأطلق الكيميائيون الأوروبيون في العصور الوسطى على حمض الكبريتيك اسم "زيت الزاج" لأنه تم تحضيره عن طريق تحميص كبريتات الحديد (II) أو الزاج الأخضر في معوجة حديدية.تظهر التلميحات الأولى إليها في الأعمال ذات الأصل الأوروبي في القرن الثالث عشر الميلادي، كما هو الحال على سبيل المثال في أعمال فنسنت أوف بوفيه، في Compositum de Compositis المنسوب إلى ألبرتوس ماغنوس، وفي كتاب جابر الزائف الخلاصة الكمال.[48]
إنتاجحمض الكبريتيك من الكبريت
عدلكانت طريقة إنتاج كبريت الأوليوم لكل كامبانام، أو "زيت الكبريت بالجرس"، معروفة في القرن السادس عشر:حيث كانت تتضمن حرق الكبريت تحت جرس زجاجي في طقس رطب (أو، لاحقًا، تحت جرس مبلل). ومع ذلك، كان غير فعال للغاية (وفقًا لجيسنر، 5 رطل (2.3 كـغ) من الكبريت المحول إلى أقل من 1 أونصة (0.03 كـغ) من الحمض)، وكان المنتج الناتج ملوثًا بحمض الكبريت (أو بالأحرى محلول ثاني أكسيد الكبريت ) لذلك فإن معظم الكيميائيين (بما في ذلك، على سبيل المثال، إسحاق نيوتن) لم يعتبروه معادلاً لـ "زيت الزاج".
في القرن السابع عشر، اكتشف يوهان جلوبر أن إضافة الملح الصخري ( نترات البوتاسيوم ،KNO3 ) يعمل على تحسين الإنتاج بشكل ملحوظ، كما يستبدل الرطوبة بالبخار. عندما يتحلل الملح الصخري، فإنه يتأكسد الكبريت إلىSO3 الذي يتحد مع الماء لينتج حمض الكبريتيك. في عام 1736، استخدم جوشوا وارد، وهو صيدلي من لندن، هذه الطريقة لبدء أول إنتاج واسع النطاق لحمض الكبريتيك.
عملية غرفة الرصاص
عدلفي عام 1746 في برمنغهام، قام جون روبوك بتعديل هذه الطريقة لإنتاج حمض الكبريتيك في غرف مبطنة بالرصاص، والتي كانت أقوى وأقل تكلفة، ويمكن تصنيعها أكبر من العبوات الزجاجية المستخدمة سابقًا. سمحت هذه العملية بالتصنيع الفعال لإنتاجحمض الكبريتيك. بعد عدة تحسينات، ظلت هذه الطريقة، التي تسمى عملية غرفة الرصاص أو "عملية الغرفة"، هي المعيار لإنتاجحمض الكبريتيك لمدة قرنين تقريبًا.
تقطير البيريت
عدلاقترب حمض الكبريتيك الناتج عن عملية جون روبوك من تركيز 65%. تحسينات لاحقة لعملية غرفة الرصاص من قبل الكيميائي الفرنسي جوزيف لويس جاي لوساك والكيميائي البريطاني جون جلوفر أدت إلى تحسين التركيز إلى 78٪. ومع ذلك، فإن تصنيع بعض الأصباغ والعمليات الكيميائية الأخرى يتطلب منتجًا أكثر تركيزًا. طوال القرن الثامن عشر، لم يكن من الممكن تحقيق ذلك إلا عن طريق التقطير الجاف للمعادن بتقنية مشابهة للعمليات الكيميائية الأصلية. البيريت (ثاني كبريتيد الحديد،FeS2تم تسخين ) في الهواء لإنتاج كبريتات الحديد (II)،FeSO4، والذي تم أكسدته عن طريق التسخين الإضافي في الهواء لتكوين كبريتات الحديد (III) ،Fe2(SO4)3، والذي عند تسخينه إلى 480 درجة مئوية، متحللة إلى أكسيد الحديد (III) وثالث أكسيد الكبريت، والتي يمكن تمريرها عبر الماء لإنتاج حمض الكبريتيك بأي تركيز. ومع ذلك، فإن تكلفة هذه العملية حالت دون الاستخدام واسع النطاق لحمض الكبريتيك المركز.
عملية الاتصال
عدلفي عام 1831، حصل تاجر الخل البريطاني بيريجرين فيليبس على براءة اختراع لعملية الاتصال، والتي كانت عملية أكثر اقتصادية بكثير لإنتاج ثالث أكسيد الكبريت وحمض الكبريتيك المركز. واليوم، يتم إنتاج كل حمض الكبريتيك الموجود في العالم تقريبًا باستخدام هذه الطريقة. [49]
أمان
عدلأنظر أيضا
عدلالمراجع
عدل- ^ ا ب ج Haynes, William M. (2014). CRC Handbook of Chemistry and Physics (بالإنجليزية) (95 ed.). CRC Press. pp. 4–92. ISBN:9781482208689. Retrieved 2018-11-18.
- ^ ا ب "NIOSH Pocket Guide to Chemical Hazards #0577". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ ا ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ص. A23. ISBN:978-0-618-94690-7.
- ^ "Sulfuric acid". Immediately Dangerous to Life and Health. المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ ا ب "Sulfuric acid safety data sheet" (PDF). arkema-inc.com. مؤرشف من الأصل (PDF) في 2012-06-17.
Clear to turbid oily odorless liquid, colorless to slightly yellow.
- ^ ا ب "Sulfuric acid – uses". dynamicscience.com.au. مؤرشف من الأصل في 2013-05-09. وسم
<ref>غير صالح؛ الاسم "OA" معرف أكثر من مرة بمحتويات مختلفة. - ^ "BASF Chemical Emergency Medical Guidelines – Sulfuric acid (H2SO4)" (PDF). BASF Chemical Company. 2012. مؤرشف من الأصل (PDF) في 2019-06-14. اطلع عليه بتاريخ 2014-12-18.
- ^ Chenier، Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. ص. 45–57. ISBN:978-0-471-01077-7.
- ^ Hermann Müller "Sulfuric Acid and Sulfur Trioxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ^ "Sulfuric acid". essentialchemicalindustry.org.
- ^ "Sulphuric acid drain cleaner" (PDF). herchem.com. مؤرشف من الأصل (PDF) في 2013-10-29.
- ^ ا ب "Sulfuric Acid". The Columbia Encyclopedia (ط. 6th). 2009. اطلع عليه بتاريخ 2010-03-16.
- ^ ا ب ج "Sulphuric acid". Encyclopædia Britannica (ط. 11th). ج. 26. 1910–1911. ص. 65–69.
- ^ ا ب ج Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9. وسم
<ref>غير صالح؛ الاسم "greenwood" معرف أكثر من مرة بمحتويات مختلفة. - ^ "Sulfuric acid" (PDF). Determination of Noncancer Chronic Reference Exposure Levels Batch 2B December 2001. 2001. مؤرشف من الأصل (PDF) في 2003-05-22. اطلع عليه بتاريخ 2012-10-01.
- ^ "Sulfuric Acid 98%" (PDF). rhodia.com. 2009. مؤرشف من الأصل (PDF) في 2011-01-07. اطلع عليه بتاريخ 2014-07-02.
- ^ Giauque، W. F.؛ Hornung، E. W.؛ Kunzler، J. E.؛ Rubin، T. R. (يناير 1960). "The Thermodynamic Properties of Aqueous Sulfuric Acid Solutions and Hydrates from 15 to 300K. 1". Journal of the American Chemical Society. ج. 82 ع. 1: 62–70. DOI:10.1021/ja01486a014.
- ^ "Consortium of Local Education Authorities for the Provision of Science Equipment -STUDENT SAFETY SHEETS 22 Sulfuric(VI) acid" (PDF). مؤرشف من الأصل (PDF) في 2013-03-31.
- ^ "Ionization Constants of Inorganic Acids". .chemistry.msu.edu. اطلع عليه بتاريخ 2011-05-30.
- ^ Dolson، David A.؛ وآخرون (1995). "Carbohydrate Dehydration Demonstrations". J. Chem. Educ. ج. 72 ع. 10: 927. Bibcode:1995JChEd..72..927D. DOI:10.1021/ed072p927. ISSN:0021-9584.
- ^ Helmenstine، Anne (18 فبراير 2020). "Carbon Snake Demo (Sugar and Sulfuric Acid)". Science Notes and Projects. اطلع عليه بتاريخ 2022-07-05.
- ^ Housecroft, Catherine E.؛ Sharpe, Alan G. (2008). "Chapter 16: The group 16 elements". Inorganic Chemistry, 3rd Edition. Pearson. ص. 523. ISBN:978-0-13-175553-6.
- ^ Kinney, Corliss Robert؛ Grey, V. E. (1959). Reactions of a Bituminous Coal with Sulfuric Acid (PDF). Pennsylvania State University. مؤرشف من الأصل (PDF) في 2017-04-28.
- ^ Carey, F. A. "Reactions of Arenes. Electrophilic Aromatic Substitution". On-Line Learning Center for Organic Chemistry. جامعة كالغاري. مؤرشف من الأصل في 2008-07-06. اطلع عليه بتاريخ 2008-01-27.
{{استشهاد ويب}}: صيانة الاستشهاد: مسار غير صالح (link) - ^ Ngo، Christian؛ Natowitz، Joseph (2016). Our Energy Future: Resources, Alternatives and the Environment. John Wiley & Sons. ص. 418–419. ISBN:9781119213369.
- ^ Pickard، Paul (25 مايو 2005). "2005 DOE Hydrogen Program Review: Sulfur-Iodine Thermochemical Cycle" (PDF). Sandia National Labs. اطلع عليه بتاريخ 2021-10-08.
- ^ Pelletreau، K.؛ Muller-Parker, G. (2002). "Sulfuric acid in the phaeophyte alga Desmarestia munda deters feeding by the sea urchin Strongylocentrotus droebachiensis". Marine Biology. ج. 141 ع. 1: 1–9. Bibcode:2002MarBi.141....1K. DOI:10.1007/s00227-002-0809-6. S2CID:83697676.
- ^ ا ب Kremser، S.؛ Thomson, L.W. (2016). "Stratospheric aerosol—Observations, processes, and impact on climate" (PDF). Reviews of Geophysics. ج. 54 ع. 2: 278–335. Bibcode:2016RvGeo..54..278K. DOI:10.1002/2015RG000511.
- ^ Krasnopolsky، Vladimir A. (2006). "Chemical composition of Venus atmosphere and clouds: Some unsolved problems". Planetary and Space Science. ج. 54 ع. 13–14: 1352–1359. Bibcode:2006P&SS...54.1352K. DOI:10.1016/j.pss.2006.04.019.
- ^ Orlando، T. M.؛ McCord، T. B.؛ Grieves، G. A. (2005). "The chemical nature of Europa surface material and the relation to a subsurface ocean". Icarus. ج. 177 ع. 2: 528–533. Bibcode:2005Icar..177..528O. DOI:10.1016/j.icarus.2005.05.009.
- ^ Jones، Edward M. (1950). "Chamber Process Manufacture of Sulfuric Acid". Industrial and Engineering Chemistry. ج. 42 ع. 11: 2208–2210. DOI:10.1021/ie50491a016.
- ^ (Harm)، Benninga, H. (1990). A history of lactic acid making: a chapter in the history of biotechnology. Dordrecht [Netherland]: Kluwer Academic Publishers. ص. 4. ISBN:9780792306252. OCLC:20852966.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Karpenko، Vladimír؛ Norris، John A. (2002). "Vitriol in the History of Chemistry". Chemické listy. ج. 96 ع. 12: 997–1005.
- ^ Karpenko & Norris 2002، صفحات 999–1000.
- ^ Multhauf، Robert P. (1966). The Origins of Chemistry. London: Oldbourne.
- ^ Needham، Joseph؛ Ping-Yü، Ho؛ Gwei-Djen، Lu؛ Sivin، Nathan (1980). Science and Civilisation in China. Volume 5, Chemistry and Chemical Technology. Part IV, Spagyrical Discovery and Invention: Apparatus, Theories and Gifts. Cambridge: Cambridge University Press. ISBN:978-0-521-08573-1.
- ^ Needham et al. 1980، p. 195, note d.
- ^ Pattin، Adriaan (1972). "Un recueil alchimique: le manuscrit Firenze, Bibl. Riccardiana, L. III. 13. 119 - Description et documentation". Bulletin de Philosophie Médiévale. ج. 14: 89–107. DOI:10.1484/J.BPM.3.143.
- ^ Moureau، Sébastien (2020). "Min al-kīmiyāʾ ad alchimiam. The Transmission of Alchemy from the Arab-Muslim World to the Latin West in the Middle Ages". Micrologus. ج. 28: 87–141. hdl:2078.1/211340.
- ^ Hoefer، Ferdinand (1866). Histoire de la chimie (ط. 2nd). Paris: Librairie de Firmin Didot.
- ^ Ruska 1939، صفحة 58; Pattin 1972، صفحة 93; Halleux، Robert (1996). "The Reception of Arabic Alchemy in the West". في Rashed، Roshdi (المحرر). Encyclopedia of the History of Arabic Science. London: Routledge. ج. 3. ص. 886–902. ISBN:9780415020633.
- ^ Ruska 1939، صفحة 58.
- ^ Ruska 1939، صفحات 58–61.
- ^ Halleux 1996، صفحة 892; Moureau 2020، صفحة 114.
- ^ Al-Hassan 2001، pp. 60, 63.
- ^ ا ب Al-Hassan 2001، صفحة 60.
- ^ Williams، Alan (2012). The Sword and the Crucible: A History of the Metallurgy of European Swords Up to the 16th Century. Leiden: Brill. ISBN:978-90-04-22783-5.
- ^ Karpenko & Norris 2002، صفحات 1002–1004.
- ^ Philip J. Chenier (1 أبريل 2002). Survey of industrial chemistry. Springer. ص. 28–. ISBN:978-0-306-47246-6. اطلع عليه بتاريخ 2011-12-23.
روابط خارجية
عدل- بطاقة السلامة الكيميائية العالمية 0362
- Sulfuric acid at The Periodic Table of Videos (University of Nottingham)
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sulfuric Acid – NIOSH Workplace Safety and Health Topic
- External Material Safety Data Sheet نسخة محفوظة 11 October 2007 على موقع واي باك مشين.
- Calculators:surface tensions, and densities, molarities and molalities of aqueous sulfuric acid
- Sulfuric acid analysis – titration freeware
- Process flowsheet of sulfuric acid manufacturing by lead chamber process
قالب:Sulfur compoundsقالب:Sulfates
[[تصنيف:مضافات رقم إي]] [[تصنيف:أحماض أكسيجينية كبريتية]] [[تصنيف:كبريتات]] [[تصنيف:كيماويات التصوير الضوئي]] [[تصنيف:أحماض معدنية]] [[تصنيف:مذيبات لاعضوية]] [[تصنيف:مركبات الهيدروجين]] [[تصنيف:مواد كيميائية منزلية]] [[تصنيف:كيمياء الاتزان]] [[تصنيف:مواد تنظيف]] [[تصنيف:مواد خيميائية]] [[تصنيف:حفازات حمضية]] [[تصنيف:حمض الكبريتيك]] [[تصنيف:صفحات بترجمات غير مراجعة]]

