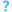سموم متلازمة الصدمة السمية
سموم متلازمة الصدمة السمية | |
|---|---|
Scanning electron micrograph of S. aureus; لون كاذب added
| |
| التصنيف العلمي | |
| النطاق: | بكتيريا |
| المملكة: | بكتيريا |
| الشعبة: | متينات الجدار |
| الطائفة: | عصيات (صنف) |
| الرتبة: | رتبة العصويات |
| الفصيلة: | مكورات عنقودية |
| الجنس: | مكورة عنقودية |
| النوع: | S. aureus |
| الاسم العلمي | |
| Staphylococcus aureus Rosenbach 1884 |
|
| تعديل مصدري - تعديل | |
سموم متلازمة الصدمة السُمية (بالإنجليزية:Toxic shock syndrome toxin) هو مستضد فوقي بحجم 22 كيلو دالتون تنتجه 5 إلى 25٪ من إفرازات المكورات العنقودية الذهبية. وهي تسبب متلازمة الصدمة السمية من خلال تحفيز إطلاق كميات كبيرة من انترلوكين 1، وانترلوكين 2 وعامل نخر الورم. بشكل عام، لا تنتج السموم من البكتيريا التي تنمو في الدم. بدلا من ذلك، يتم إنتاجه في الموقع الموضعي للعدوى، ثم يدخل مجرى الدم.
الخصائص عدل
سم متلازمة الصدمة السمية 1 (تسست-1)، هو النموذج الأولي للمستضد الفوقي، يفرز من سلالة بكتيريا المكورات العنقودية الذهبية في المضيفين المشكوك بإصابتهم، ويعمل على الجهاز الوعائي عن طريق التسبب في الالتهاب والحمى والصدمة.[1] هذه السلالة الجرثومية التي تنتج السم 1 يمكن العثور عليها في أي منطقة من الجسم، ولكن يعيش معظمها في مهبل النساء المصابات. تسست-1 هو سم خارجي بكتيري موجود في المرضى الذين أصيبوا بمتلازمة الصدمة السمية، والتي يمكن العثور عليها عند امرأة تحيض أو أي رجل أو طفل لهذا الاعتبار.[2] تم العثور على الثلث من جميع حالات الصدمة السمية لدى الرجال.[3] هذه الإحصائية يمكن أن تكون بسبب الجروح الجراحية أو أي جرح في الجلد.[3] السم 1(تسست-1) هو سبب 50٪ من الحالات التي لا تحيض و 100٪ من جميع حالات متلازمة الصدمة السمية التي تحيض.[4]
البنية عدل
في تسلسل النيوكليوتيدات في السم 1، هناك 708 إطار زوجي القواعد مفتوح القراءة وتسلسل شاين دالغارنو الذي هو سبعة أزواج قواعد تنازلية من موقع البداية.[5] في تسلسل النيوكليوتيدات بأكمله، فقط 40 حمض أميني يشكل ببتيد الإشارة. يتكون ببتيد الإشارة الواحد من 1 إلى 3 محطات من الأحماض الأمينية الأساسية، ومنطقة كارهة للماء من 15 عنصر متبقي، وبرولين (برو) وأورغليسين (غلي) في المنطقة الأساسية الكارهة للماء، وسيرين (سر) أوالحمض الأميني ثريونين (ثر) بالقرب من نهاية طرف الكربوكسيل من القلب الكاره للماء، وألانين (ألا) أو الجلايسين (جلي) في موقع الانقسام.[5] بروتين السم1المكتمل لديه تسلسل الترميز من 585 زوج من القواعد.[5] تم تحديد تسلسل النوكليوتيدات بأكمله من قبل بلومستر-هوتمازغ، وآخرون، وكذلك من قبل باحثين آخرين مع تجارب أخرى.[5] مكونا من سلسلة بولي بيبتيد واحدة، نبية السم 1 ثلاثية الأبعاد وهو يتألف من مجالي ألفا (α) وبيتا (β).[6] تم تحديد هذا الهيكل ثلاثي الأبعاد لبروتين السم عن طريق تنقية بلورات البروتين.[6] المجالين متجاورين من بعضهما البعض ويتمتعان بخصائص فريدة. يحتوي المجال «أ»، وهو أكبر المجالين، على بقايا 1-17 و 90-194 في السم 1، ويتكون من حلزون ألفا طويل (α) مع مخلفات 125-140 محاطة بطبقة بيتا من 5 فروع.[4][6] المجال «ب» فريد لأنه يحتوي على بقايا 18-89 في السم 1 ويتألف من أنبوب (β) يتكون من 5 β- فروع.[6] وتبين طرق البلورات أن أنبوب β الداخلي للمجال ب يحتوي على عدة أحماض أمينية كارهة للماء ومخلفات مائية على سطح المجال، مما يسمح للسم 1 بعبور الأسطح المخاطية للخلايا الظهارية.[6] على الرغم من أن السم -1 يتكون من عدة أحماض أمينية معادية للماء، إلا أن هذا البروتين قابل للذوبان للغاية في الماء.[4] السم-1 مقاوم للحرارة وتحلل البروتين. فقد تبين أن السم-1 يمكن أن يغلي لمدة أكثر من ساعة دون أي وجود تغير في طبيعته أو تأثير مباشر على وظيفته.[4]
الإنتاج عدل
السم-1 هو بروتين مشفر من قبل الجين (tstH)، والذي هو جزء من عنصر الجينات العنقودية الذهبية ذات القدرة المرضية «جزيرة 1».[6] يتم إنتاج السموم في أحجام أكبر خلال المرحلة ما بعد الأُسّية من النمو، وهو شئ متشابه بين المستضدات الفوقية ذات السم مسبب الحمى، المعروفة أيضا باسم (مستضدات PTS).[6] الأكسجين مطلوب من أجل إنتاج السم1،[7] بالإضافة إلى وجود البروتين الحيواني، ومستويات منخفضة من الجلوكوز، ودرجات الحرارة بين 37-40 درجة مئوية (98.6-104 درجة فهرنهايت).[6] يحدث الإنتاج الأمثل في درجة حموضة على مقربة من الحياد وعندما تكون مستويات المغنيسيوم منخفضة، [8] ويتضخم الإنتاج كذلك في تركيزات عالية من العنقودية الذهبية، مما يدل على أهميتها في إنشاء العدوى.[6]
يختلف السم 1 عن مستضدات PTS الأخرى في أن تسلسله الجيني ليس له مثلية مع متواليات مستضدات فوقية أخرى.[6] ليس لدى السم 1 حلقة سيستين، وهي مكون هام في مستضدات PTS الأخرى،[9] وفي الحقيقة ليس لديه أي من مكون السيستين على الإطلاق.[6] السم-1 يختلف أيضا عن مستضدات PTS الأخرى في قدرته على عبور الأغشية المخاطية، وهذا هو السبب في أنه هو عامل مهم في متلازمة الصدمة السمية في الحيض،[6] عندما يترجم البروتين، يكون في شكل بروـ بروتين، ويمكن أن يترك الخلية بمجرد انفصال تسلسل الإشارة فقط.[6] يعد موقع الإكساغر أحد المواقع الرئيسية للتنظيم الإيجابي لكثير من جينات الذهبية العنقودية، بما في ذلك السم 1 (تسست-1).[9] بالإضافة إلى ذلك، فإن البدائل في التعبير عن الجينات ssrB و srrAB تؤثر على نسخ من السم-1.[7] علاوة على ذلك، فإن مستويات عالية من الجلوكوز تمنع النسخ، حيث أن الجلوكوز بمثابة كابح هدمي.[6]
الطفرات عدل
استنادا إلى دراسات عن طفرات البروتين المختلفة يبدو أن أجزاء المستضد الفوقي والأجزاء الفتاكة من البروتين منفصلة.[6] كان أحد المتغيرات على وجه الخصوص، تسست-أوفين أو تسست-أوه، مُهما في تحديد المناطق ذات الأهمية البيولوجية في تسست-1(السم 1).[10] تسست-أوه لا يسبب متلازمة الصدمة السمية، وهو غير مسبب للانقسام الفتيلي، ويختلف عن تسلسل تسست-1 في 14 نيوكليوتيدة، وهو ما يتوافق مع 9 من الأحماض الأمينية.[10] اثنين منهم ينفصلان كجزء من تسلسل الإشارة، وبالتالي ليست مهمة في الفرق في الوظيفة الملاحظة.[10] من الدراسات التي رصدت الاختلافات في هذين البروتينين، تم اكتشاف أن موضع الحمض 135 بالغ الأهمية في كل من معدل الفتك والانقسام التفتلي، في حين أن الطفرات في الحمضين 132 و 136 تسببت في فقدان البروتين قدرته على إحداث متلازمة الصدمة السمية، ولكن لا تزال هناك علامات على المستضد الفوقي.[11] من المثير للاهتمام، إذا تم تغيير الليسين في الموقع 132 في تسست-أوه إلى الجلوتاميت، فإن المتحول يستعيد صفة المستضد الفوقي قليلا، ولكن يصبح قاتلا، وهذا يعني أن القدرة على إحداث متلازمة الصدمة السمية ناتجة من الجلوتاميت عند الموقع 132.[10][11] فقدان النشاط من هذه الطفرات ليس بسبب التغيرات في تشكل البروتين، ولكن بدلا من ذلك يبدو أن هذه المواقع حاسمة في التفاعلات مع مستقبلات الخلايا "T".[11]
العزل عدل
يمكن تنقية عينات من تسست-1 من المزارع البكتيرية لاستخدامها في اختبارات في بيئة المختبر، ولكن هذا ليس مثاليا بسبب العدد الكبير من العوامل التي تسهم في إحداث المرض في بيئة داخل الجسم الحي.[8] بالإضافة إلى ذلك، زراعة البكتيريا في المختبر يوفر بيئة غنية بالمواد المغذية، على النقيض من واقع البيئة في الجسم الحي، حيث تميل العناصر الغذائية إلى أن تكون أكثر ندرة.[8] يمكن تنقية تسست-1 بواسطة التركيز التحضيري متساوي التكهرب للاستخدام في المختبر أو للنماذج الحيوانية باستخدام مضخة تنافذية مصغرة.[12]
الآلية عدل
المستضد الفوقي مثل تسست-1 يحفز خلايا T البشرية التي تحرر "VB 2"، والتي قد تمثل 5-30٪ من جميع الخلايا T لدى المضيف. تحفز مستضدات PTS توسع VB المحدد لكل من المجموعات الفرعية كتلة التمايز 4 (CD4) وكتلة التمايز8 (CD8)- من الخلايا اللمفية T. يأخذ تستست-1 جزيئات متشابهة في معظم أشكال الكريستال المعروفة.[6] يظهر التحليل المحدد بنية السم المحفوظة بشكل ملحوظ وتنقسم إلى المجالين النهائيين N- و C-. رسم التحليل الطفرى منطقة افتراضية للارتباط TCR للسم -1 إلى موقع يقع على الأخدود الخلفي. إذا كان TCR يحتل هذا الموقع، تشكل الأحماض الأمينية ألفا الطرفية وتد كبير بين جزيئات TCR و MHC من الدرجة الثانية.سوف يمثل الوتد فصلا فزيائيا بين TCR وجزيئات الطبقة الثانية من MHC. قد يوجد مجال جديد في المستضدات الفوقية منفصل عن مجالات الارتباط في TCR والطبقة الثانية من MHC . يتكون المجال من رواسب 150 إلى 161 في العنقوديات المعوية من النوع ب، وتوجد مناطق مماثلة في جميع المستضدات الفوقية الأخرى كذلك. في هذه الدراسة كان الببتيد الاصطناعي الذي يحتوي على هذا التسلسل قادرا على منع الموت الناجم عن المستضد الفوقي في الفئران المُحسسة بجلاكتوزامين دي من السم 1 للعنقوديات، فضلا عن بعض المستضدات الفوقية الأخرى. توجد اختلافات كبيرة في متواليات الأليلات MHC من الدرجة الثانية وعناصر TCR فبيتا التي تظهر في أنواع مختلفة،[6][13] وهذه الاختلافات لها آثار هامة على تفاعل مستضدات PTS ومع جزيئات MHC من النوع الثاني و TCR.
موقع الارتباط عدل
يرتبط تسست-1 في المقام الأول بسلسلة ألفا من الصنف الثاني من MHC حصريا من خلال موقع ارتباط منخفض القابلية (أو عام) في مجال المستضد الفوقي النهاية N. هذا يعارض المستضدات الفوقية الأخرى مثل DEA و SEE، التي ترتبط مع الدرجة الثانية MHC من خلال موقع منخفض القابلية، ومع سلسلة بيتا من خلال موقع عالي القابلية. هذا الموقع عالي القابلية هو موقع يعتمد على الزنك على نطاق النهاية C. عندما يكون هذا الموقع مرتبطا، فإنه يمتد على جزء من أخدود الارتباط، مكونا اتصالات مع الببتيد المرتبط، ثم يربط مناطق كل من سلاسل ألفا وبيتا.[13] يعتمد ارتباط MHC وتسست-1 جزئيا على الببتيد. أشارت دراسات التطفر على العنقودية المعوية نوع أ إلى أن كلا موقعي الارتباط مطلوبين لتنشيط الخلايا T بشكل مثالي. هذه الدراسات التي تحتوي على تسست-1 تشير إلى أن مجال ربط TCR يقع في الجزء العلوي من الجانب الخلفي من هذا السم، على الرغم من أن التفاعل الكامل لا يزال يتعين تحديده. كانت هناك أيضا مؤشرات على أن موقع ربط TCR من تست-1 يتم تعيينه في الأخدود الرئيسي من الحلزون ألفا المركزي أو الحلزون الأميني النهائي القصير ألفا. ومن المعروف أن الرواسب الموجودة في قالب مخلب بيتا من تسست-1 تتفاعل بشكل أساسي مع المنطقة الثابتة لسلسلة ألفا من هذا الجزيء الثاني من مركب MHC .[6] كما تم تحديد رواسب تصنع اتصالات طفيفة مع تسست-1 في سلسلة بيتا HLA-DR1، وكذلك الببتيد المستضد، الموجود في الأخدود بين السلاسل. ويفرض ترتيب تسست-1 فيما يتعلق بجزيء MHC من الطبقة الثانية قيودا استثنائية على مركب المكون الثلاثي المكون من الطبقة تسست-1 و MHC من الطبقة الثانية و TCR.[6]
التحليل الطفري عدل
أظهرت الدراسات الأولية على مواضع الطفرات أن الرواسب على الجانب الخلفي من الحلزون ألفا المركزي كانت مطلوبة لنشاط المستضد الفوقي. تغيير الهستيدين في الموقف 135 إلى ألانين تسبب في أن يكون تسست-1 أن غير قاتل ولا مستضد فوقي. التغيرات في المواقع التي كانت على مقربة من هستيدين 135ألانين، كان لها أيضا تأثير يقلل من قدرة الفتك وجودة المستضد الفوقي في هذه المتغيرات. على الرغم من أن معظم هذه التغيرات لم تؤدي إلى فقدان صفة المستضد من تسست-1. وأظهرت الاختبارات التي أجريت باستخدام سموم تسست-1 الطافرة أن خصائص قدرة الفتك والمستضد قابلة للفصل. عندما تم تغيير ليسين-132 في تسست-أوه إلى غلو، أصبح المتغير الناتج قاتل تماما ولكنه ليس مستضد فوق. نفس النتائج، «قاتل ولكن ليس مستضد فوقي»، تم العثور عليها في تسست-1 جلايسين 17 فالين. بقايا جلي16، وغلو 132، وغلن 136، وتقع على الجزء الخلفي من الجانب الخلفي للأخدود من منطقة ارتباط TCR المفترضة من تسست-1، فقد اقترح أنها أيضا جزء من الموقع الوظيفي الثاني القاتل في TSST- 1.[6]
انظر أيضا عدل
المصادر عدل
- ^ Todar, Kenneth. (2012). "Bacterial Protein Toxins". Todar's Online Textbook of Bacteriology. Madison, Wisconsin. نسخة محفوظة 27 يوليو 2017 على موقع واي باك مشين.
- ^ Edwin, Chitra, Parsonnet, Jeffrey, Kass, Edward H. (December 1988). "Structure-Activity Relationship of Toxic-Shock-Syndrome Toxin-1: Derivation and Characterization of Immunologically and Biologically Active Fragments". The Journal of Infectious Diseases 158(6): 1287. نسخة محفوظة 20 مارس 2016 على موقع واي باك مشين.
- ^ أ ب Bushra, Joseph S. "Toxic Shock Syndrome Causes". eMedicineHealth.com. WebMD, Inc. Retrieved 3/28/12. نسخة محفوظة 07 نوفمبر 2017 على موقع واي باك مشين.
- ^ أ ب ت ث McCormick, John K., Tripp, Timothy J., et al. (April 2012). "Functional Analysis of the TCR Binding Domain of Toxic Shock Syndrome Toxin-1 Predicts Further Diversity in MHC Class II/Superantigen/TCR Ternary Complexes". The Journal of Immunology 171:185-1392. [وصلة مكسورة] نسخة محفوظة 11 يناير 2020 على موقع واي باك مشين.
- ^ أ ب ت ث BLomster-Hautamaa, Debra A., Kreiswirth, Barry N,. et al. (1986). "The Nucleotide and Partial Amino Acid Sequence of Toxic Shock Syndrome Toxin-1*." The Journal of Biological Chemistry 261 (33):15783-15786.a نسخة محفوظة 7 أبريل 2020 على موقع واي باك مشين.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف Dinges, M. M., P. M. Orwin, et al. (2000). "Exotoxins of Staphylococcus aureus." Clinical Microbiology Reviews 13(1): 16-34. نسخة محفوظة 26 فبراير 2014 على موقع واي باك مشين.
- ^ أ ب Yarwood, J. M., J. K. McCormick, et al. (2001). "Identification of a Novel Two-Component Regulatory System That Acts in Global Regulation of Virulence Factors of Staphylococcus aureus." Journal of Bacteriology 183(4): 1113-1123. نسخة محفوظة 13 مارس 2020 على موقع واي باك مشين.
- ^ أ ب ت Cunningham, R., A. Cockayne, et al. (1996). "Clinical and molecular aspects of the pathogenesis of Staphylococcus aureus bone and joint infections."[وصلة مكسورة] Journal of Medical Microbiology 44(3): 157-164. نسخة محفوظة 2016-03-05 على موقع واي باك مشين.
- ^ أ ب Iandolo, J. J. (1989). "Genetic Analysis of Extracellular Toxins of Staphylococcus Aureus." Annual Review of Microbiology 43(1): 375-402. نسخة محفوظة 11 يناير 2020 على موقع واي باك مشين.
- ^ أ ب ت ث Murray, D., G. Prasad, et al. (1994). "Immunobiologic and biochemical properties of mutants of toxic shock syndrome toxin-1." The Journal of Immunology 152(1): 87-95. نسخة محفوظة 11 يناير 2020 على موقع واي باك مشين.
- ^ أ ب ت Murray, D. L., C. A. Earhart, et al. (1996). "Localization of biologically important regions on toxic shock syndrome toxin 1." Infection and Immunity 64(1): 371-374. نسخة محفوظة 7 أبريل 2020 على موقع واي باك مشين.
- ^ De Boer, M. L., W. W. Kum, et al. (1999) "Interaction of Staphylococcal Toxic Shock Syndrome Toxin-1 and Enterotoxin A on T cell Proliferation and TNFα Secretion in Human Blood Mononuclear Cells." نسخة محفوظة 5 مارس 2016 على موقع واي باك مشين. Canadian Journal of Infectious Diseases & Medical Microbiology 10, 403-409. "نسخة مؤرشفة". مؤرشف من الأصل في 2016-03-04. اطلع عليه بتاريخ 2017-05-21.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ أ ب John McCormick, Jeremy M. Yarwood, and Patrick M. Schlievert. (2001). "Toxic Shock Syndrome and Bacterial Superantigens: An Update". Annual Review of Microbiology 55: 77-104. نسخة محفوظة 14 أبريل 2020 على موقع واي باك مشين.
| في كومنز صور وملفات عن: سموم متلازمة الصدمة السمية |