لوكيميا الأرومة اللمفاوية الحادة
لوكيميا الأرومة اللمفاوية الحادة[4] أو ابيضاض الدم الليمفاوي الحاد (بالإنجليزية: Acute Lymphocytic Leukemia) هو مرض سرطاني يحدث بسبب تكاثر غير طبيعي للخلايا الأرومية الليمفاوية في نخاع العظم.[5][6][7] يتم تشخيص 4000 حالة سنويا في الولايات المتحدة وبمعدل إصابة 1.4/100000 شخص. يصيب البالغين وخاصة من عمر الخمسين فما فوق، ويعد من أكثر السرطانات شيوعا في مرحلة الطفولة وخاصة ما بين الأطفال من 3-7 سنوات حيث يشكل ما نسبته 30% من الأمراض السرطانية التي تصيب الأطفال.
| لوكيميا الأرومة اللمفاوية الحادة | |
|---|---|
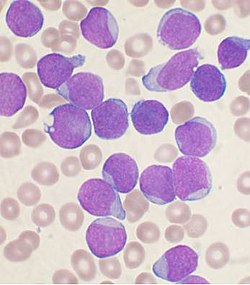
نضح العظم تشويه من شخص مع السلائف B- الخلية ALL. الخلايا الأرجواني الكبيرة هي الأورام اللمفاوية.
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | لوكيميا حادة[1]، ومرض |
| المظهر السريري | |
| الأعراض | حمى[2]، وضعف[2]، وإعياء[2]، وفقدان الوزن[2]، وفقدان الشهية[2]، وآلام العظم[2]، وألم البطن[2]، وضيق النفس[2] |
| الإدارة | |
| أدوية | |
| تعديل مصدري - تعديل | |
يعد أبيضاض الدم الليمفاوي الحاد الذي يصيب الخلية الليمفاوية من نوع B الأكثر شيوعا ونسبة الأصابة به ما بين الذكور والإناث متساوية، على عكس المرض الذي يصيب الخلية الليمفاوية من نوع T حيث تظهر الإحصاءات نسبة اصابة أعلى في الذكور من الإناث 1.3: 1.0.
سبب الإصابة
عدلمقالة رئيسية أبيضاض الدم؛ مسببات المرض
لا يعرف ماهو المسبب الرئيسي للمرض إلا أن الإشعاعات الناتجة من القنبلة الذرية وبعض المركبات الكيميائية مثل البنزين يكون لها دور في التسبب بالمرض.
الأعراض
عدلتظهر الأعراض تدريجيا على المريض وقد تأخذ أسابيع إلى عدة أشهر وقد تظهر بشكل مفاجئ وحاد. تكون الأعراض بشكل عام:
- شحوب وضيق في النفس وبعض التوعكات وذلك بسبب فقر الدم الحاصل.
- ارتفاع حرارة المريض وذلك بسبب تكاثر الخلايا السرطانية.
- آلام في المفاصل والعظام بسبب تسلل الخلايا السرطانية للسمحاق وتآكل العظم. مما يسبب اضطرابات في المشي وخاصة عند الأطفال مما يجعلهم رافضين للمشي على الأقدام
- كدمات ونزيف تحت الجلد ونزيف من اللثة نتيجة نقص الصفائح الدموية.
- تضخم في الكبد والطحال والغدد الليمفاوية.
- يظهر ما نسبته 2% من حالات الإصابة بالمرض عند الأطفال وجود الخلايا السرطانية في سائل النخاع الشوكي مما يسبب صداع وتقيأ. وما نسبته 10% عند البالغين.
- وجود بعض الأورام في منطقة الصدر وخاصة عند البالغين المصابين بالمرض من نوع السلسلة T.
- الرغبة الملحة في النوم للشعور بالإرهاق الشديد.
- عدم وجود رغبة لتناول الطعام أو الشراب.
التصنيف
عدلتم تصنيف المرض بالاعتماد على شكل الخلايا السرطانية أو النمط الظاهري المناعي بواسطة مجموعة من العلماء الفرنسيين والأميركيين والبريطانيين (فاب) إلى:
- تصنيف حسب شكل الخلايا السرطانية:
- L1 وتكون الخلايا الأرومية موحدة الشكل وصغيرة وتتميز أيضا بقلة ومحدودية سائل السايتوبلازم.
- L2 وتكون الخلايا الأرومية أكبر من النوع السابق ومتغير وكذلك وجود نوية ويكون سائل السيتولازم أكثر تعقيدا لاحتوائه على بعض العضيات.
- L3 خلايا أرومية أكبر من الأنواع السابقة مع نوية أكثر بروز ونضج من النوية السابقة وسائل سايتوبلازمي شديد القاعدية ووجود بعض الفجوات فيه.
- النمط الظاهري المناعي:
و يتم تقسيم المرض إلى نوعين وذلك بحسب عناقيد التمايز (Clusters of Differentiation) الموجودة على الخلايا الآرومية
- أبيضاض دم ليمفاوي حاد من نوع B وتصل نسبتها إلى 78% من الحالات.
- أبيضاض دم ليمفاوي حاد من نوع T تشكل 22% من حالات الإصابة.
الإمراض الجزيئي
عدلوجد العديد من الاضطرابات والاعتلالات الجزيئية في مرضى أبيضاض الدم الليمفاوي الحاد من أهمها:
- الاتحاد الجيني ما بين المورثة ABL والمورثة BCR (أو كما يعرف بكروموسوم فيلادلفيا) الناتج من الانتقال المكاني بين الكروموسومين 9 و 22 (t(9;22)q(34;q11 مما يؤدي إلى عمليات نقل إشارة لبروتينات لها دور في نمو الخلايا. 20-30% من حالات الإصابة عند البالغين، بينما لا تتعدى أكثر من 3% في حالات الإصابة عند الأطفال.
- حدوث طفرات جينية في عدد من العوامل الناسخة التي لها دور رئيسي في عملية تكوين الدم. مثل عملية الانتقال المكاني بين الكروموسومين 12 و 21 (t(12;21)q(13;q22 مما ينتج تجاور للمورثتين AML1 و TEL.
- حدوث اضطرابات في المورثات المثبطة للأورام مثل حذف أجزاء من المورثتين (p16(INK4A و(p15(INK4B
مآل المرض
عدلهناك عدة عوامل ممكن أن تحدد مآل المرض كما يبينها الجدول.
| العوامل المحددة لسير المرض
| |||
| العامل | جيد | سيئ | |
|---|---|---|---|
| عدد كريات الدم البيض | منخفض | مرتفع | |
| الجنس | إناث | ذكور | |
| النمط الظاهري المناعي | B | T | |
| العمر | طفل | بالغ | |
| الوراثة الخلوية | صورة طبيعية أو TEL | كروموسوم فيلادلفيا | |
| مدة إزالة الخلايا الأرومية من الدم | أقل من إسبوع | أكثر من إسبوع | |
| مدة تهدئة المرض | أقل من 4 أسابيع | أكثر من 4 أسابيع | |
| وجود أعراض إصابة الجهاز العصبي المركزي | غير موجودة | موجودة | |
| الحد الأدنى من بقايا المرض | غير موجودة من فترة 1-3 شهور | موجودة بعد 3-6 شهور | |
التشخيص المخبري
عدل- عد كامل لمكونات الدم (Complete Blood Count) وقد يظهر هذا الفحص زيادة في أعداد كريات الدم البيضاء وفي بعض الحالات تكون ضمن العدد الطبيعي. ويظهر الفحص أيضا هبوط في مستوى الهيموكلوبين والصفائح.
- أخد خزعة من نخاع العظم لدراسته نسيجيا. معظم الحالات تظهر وجود أعداد كبيرة من الخلايا الآرومية (ما لا يقل عن 90% من الخلايا).
- التهجين الموضعي المتألق وذلك لدراسة الخلايا السرطانية وملاحظة وجود أية اختلالات وراثية (انتقالات مكانية أو حذف لأجزاء من الكروموسومات). معرفة نوع الاضطراب الخلوي قد يساعد الطبيب على توقع مسار المرض.
- النمط الظاهري المناعي: وذلك بدراسة عناقيد التمايز الموجودة على الخلايا الأرومية وتحديد نوع المرض (B أو T) وهذا العامل أيضا له دور في تحديد مسار المرض.
العلاج
عدليتم علاج المرض بواسطة عدة طرق مثل العلاج الكيميائي والعلاج بالأشعة وزراعة نخاع العظم الخيفي واستخدام الأضداد وحيدة النسيلة (Monoclonal Antibodies) إلا أن العلاج الأخير ما زال تحت التجارب السريرية.
العلاج الكيميائي
عدلتتم تقسيم عملية العلاج إلى عدة مراحل
1. تهدئة المرض: في هذه المرحلة الهدف الرئيسي من العلاج هي محاولة القضاء على الخلايا السرطانية والوصول إلى مرحلة التهدئة وتتمثل بعدم زيادة نسبة الخلايا الأرومية في نخاع العظم عن 5% وصورة طبيعية للدم المحيطي وعدم وجود أية أعراض للمرض. يتم علاج المريض بواسطة بردنيسلون (Prednislone) وديكساميثاسون (Dexamethasone) وفينكريستين (Vincristine) وأسبارجنيز (Asparginase). يتم الوصول إلى التهدئة في 90% من الحالات الإصابة بالمرض عند الأطفال و 80 - 90% من حالات الإصابة عند البالغين.
2. تكثيف العلاج: يتم دمج عدة أدوية مع بعضها وتعطى للمريض بهدف محاولة القضاء على المرض أو تقليل الخلايا السرطانية بشكل كبير إلى مستويات ضئيلة جدا. أدوية مثل فينكريستين (Vincristine) وسيكلوفوسفامايد (cyclophsphamide) وسايتوسين أرابينوسايد (Cytosine Arabinoside) وثايوكوانين (Thioguanine) وإيتوبوسايد (Etoposide) ومركابتوبيورين (Mercaptopurine) تعطى للمريض على شكل توليفات مختلفة حسب حالة المريض وقدرته على التحمل.
3. مداومة العلاج: وتستمر من 2-3 سنوات، يعطى المريض جرعة يومية عن طريق الفم من مركابتوبيورين (Mercaptopurine) وجرعة إسبوعية من ميثوتركسيت (Methotrexate). يتم تقليل العلاج تدريجيا عن التأكد من عدم وجود الحد الأدنى من بقايا المرض (Minimal Residual Disease).
في بعض الحالات التي يتم فيها انتشار الخلايا السرطانية في الجهاز العصبي المركزي يتم علاج المريض بواسطة ميثوتركسيت (Methotrexate) أو عن طريق التشعيع القحفي (Cranial Irradiation) إلا أنه بفضل عدم استخدام التشعيع القحفي مع المصابين من الأطفال.
طرق أخرى للعلاج
عدل- زراعة نخاع العظم الخيفي في بعض الحالات التي لا تبدي أي تقدم أو تحسن عند استخدام العلاج الكيميائي. إلا أن لهذا العلاج يتوجب بعض الشروط مثل عمر المريض وحالته ووجود متبرع مناسب، وينطوي هذا العلاج على بعض المخاطر مثل عدم نجاح الزراعة مما يؤدي إلى تحفيز المريض مناعيا ومرض المريض ضد الطعم.
- استخدام علاج إيمينتاب للمرضى المصابين بكروموسوم فيلادلفيا ويظهرون وجود الاتحاد الجيني BCR-ABL.
- استخدام الأضداد وحيدة النسيلة. ويتم توجيه هذه الأضداد إلى الخلايا السرطانية بحسب عناقيد التمايز التي تظهرها. أظهرت الأبحاث أن استخدام روتكسيماب (Rituximab) -موجه ضد عنقود التمايز 20- وكامباث 1 (Campath-1) - موجه ضد عنقود التمايز 52 - مع العلاج الكيميائي يعطي نتائج جيدة. بعض الأدوية لعناقيد تمايز أخرى ما زالت تحت التجارب السريرية
معرض صور
عدلانظر أيضًا
عدلالمراجع
عدل- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ https://medlineplus.gov/acutelymphocyticleukemia.html.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة) والوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة) - ^ Inxight: Drugs Database، QID:Q57664317
- ^ قاموس مرعشي الطبي الكبير نسخة محفوظة 22 أكتوبر 2017 على موقع واي باك مشين.
- ^ Lambrou GI، Papadimitriou L، Chrousos GP، Vlahopoulos SA (يناير 2012). "Glucocorticoid and proteasome inhibitor impact on the leukemic lymphoblast: multiple, diverse signals converging on a few key downstream regulators". Mol Cell Endocrinol. ج. 351 ع. 2: 142–51. DOI:10.1016/j.mce.2012.01.003. PMID:22273806.
- ^ "ACS :: How Is Acute Lymphocytic Leukemia Classified?". مؤرشف من الأصل في 2008-03-23.
- ^ Seiter, K (5 فبراير 2014). Sarkodee-Adoo, C؛ Talavera, F؛ Sacher, RA؛ Besa, EC (المحررون). "Acute Lymphoblastic Leukemia". Medscape Reference. WebMD. مؤرشف من الأصل في 18 أبريل 2014. اطلع عليه بتاريخ 17 أبريل 2014.
- Dieter Hoelzer and Nicola Gökbuget, Adult Acute Lymphocytic Leukemia. In Hoffbrand V, Tuddenham E and Catovsky D ed. Postgraduate Haematology. Blackwell Publishing;2005:525-541.
- Der-Cherng Liang and Ching-Hon Pui, Childhood Acute Lymphocytic Leukemia. In Hoffbrand V, Tuddenham E and Catovsky D ed. Postgraduate Haematology. Blackwell Publishing;2005:542-560.
- Hoffbrand V, Moss P, Pettit J. Essential Haematology. Blackwell Publishing;2006:159-167.
- Thai M. Cao and Steven E Courte, Acute Lymphocytic Leukemia in adults. In Greer J, Forester J, Lukens J, Rodgers G, Paraskevas F, Glader B ed. Wintrobe's Clinical Hematology, 11th edition. Lippincott Williams and Wilkins Publishing;2004:2077-2096.
- James A. Whitelock and Paul S Gaynon, Acute Lymphocytic Leukemia in Children. In Greer J, Forester J, Lukens J, Rodgers G, Paraskevas F, Glader B ed. Wintrobe's Clinical Hematology, 11th edition. Lippincott Williams and Wilkins Publishing;2004: 2169-2190.