كوماسي بريلينت بلو
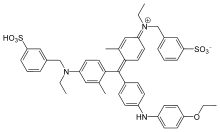
كوماسي بريلينت بلو (بالإنجليزية: Coomassie Brilliant Blue)، هو اسم اثنين من أصباغ triphenylmethane المتماثلة التي تم تطويرها للاستخدام في صناعة النسيج ولكنها الآن تستخدم عادة لتلطيخ البروتينات في الكيمياء الحيوية التحليلية. يختلف Coomassie Brilliant Blue G-250 عن Coomassie Brilliant Blue R-250 عن طريق إضافة مجموعتي ميثيل. الاسم "Coomassie " وهو علامة تجارية مسجلة لشركة Imperial Chemical Industries
| كوماسي بريلينت بلو | |
|---|---|
| الخواص | |
| الصيغة الجزيئية | C₄₅H₄₄N₃NaO₇S₂[1] |
| المعرفات | |
| CAS | 6104-59-2 |
| بوب كيم | 61365، و121540606 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |

الاسم والاكتشاف
عدلتم تبني الاسم Coomassie في نهاية القرن التاسع عشر كإسم تجاري من قبل شركة Blackley لصبغ أساس Levinstein. Ltd ، في تسويق مجموعة من أصباغ الصوف الحمضية.[2] في عام 1896 خلال الحرب الأنجلو آشانتي الرابعة، احتلت القوات البريطانية مدينة كوماسي (كوماسي الحديثة في غانا). في عام 1918 أصبح Levinstein المحدودة جزءا من الأصباغ البريطانية التي أصبحت في عام 1926 جزءا من الصناعات الكيميائية الإمبراطورية. على الرغم من أن ICI لا يزال يمتلك العلامة التجارية Coomassie ، فإن الشركة لم تعد بتصنيع الأصباغ.
تم إنتاج الصبغات الزرقاء triphenylmethane المسلفنة لأول مرة في عام 1913 من قبل ماكس Weiler الذي كان مقره في Elberfeld ، ألمانيا. في وقت لاحق تم أخذ براءات الاختراع المختلفة على التخليق العضوي.[3] Various patents were subsequently taken out on the organic synthesis.[4][5][6]
تشير الأبحاث المنشورة في مجلات الكيمياء الحيوية إلى هذه الصبغات ببساطة باسم "Coomassie" دون تحديد أي الصبغة المستخدمة بالفعل. في الواقع، يسرد «فهرس الألوان» أكثر من 40 صبغة باستخدام "Coomassie" في أسمائهم. هناك أيضا غيرها من الأصباغ الزرقاء "Coomassie". على سبيل المثال، يسرد مؤشر Merck (الطبعة العاشرة) Coomassie Blue RL (Acid Blue 92، CI 13390) الذي له بنية مختلفة تمامًا.
لون الصبغة
عدلاللاحقة "R" في اسم Coomassie Brilliant Blue R-250 هي اختصار لـ Red حيث أن اللون الأزرق للصبغة له لون ضئيل محمر. بالنسبة إلى متغير "G"، فإن اللون الأزرق يحتوي على لون أكثر خضرة. ويشير "250" في الأصل إلى نقاء الصبغة.
يعتمد لون الصبغتين على حموضة المحلول. تمت دراسة شكل "G" للصبغة بالتفصيل. عند الرقم الهيدروجيني أقل من 0، يكون للصبغة لون أحمر مع أقصى حد امتصاص يبلغ طوله 465 نانومتر. عند درجة حموضة (pH) حوالي 1، تكون الصبغة خضراء مع حد أقصى للامتصاص عند 620 نانومتر، بينما فوق درجة الحموضة 2 تكون الصبغة زرقاء زاهية بحد أقصى 595 نانومتر. عند الرقم الهيدروجيني 7، يكون للصبغ معامل انقراض قدره 43000 متر مكعب − 1 سم – 1.
الألوان المختلفة هي نتيجة للحالات المشحونة المختلفة لجزيء الصبغة. في الشكل الأحمر، تحمل كل ذرات النيتروجين الثلاثة شحنة موجبة. تحتوي مجموعتا حمض السلفونيك على pKa منخفض للغاية، وعادة ما تكون مشحونة سالبًا، وبالتالي عند درجة حموضة تبلغ صفر تقريبًا، ستكون الصبغة عبارة عن كاتيون مع شحنة إجمالية تبلغ 1. ويتوافق اللون الأخضر مع شكل من الصبغة بدون صافي إجمالي الشحنة. في الوسائط المحايدة (الأس الهيدروجيني 7)، فإن ذرة النيتروجين فقط لشجرة الديفينيلامين تحمل شحنة موجبة وجزيء الصبغة الأزرق هو عبارة عن أنيون له شحنة إجمالية تبلغ −1. و pKa لفقدان البروتونات هما 1.15 و 1.82 على التوالي. يتم فقدان البروتون النهائي تحت الظروف القلوية ويصبح الصبغة لونًا ورديًا (pKa 12.4).
تتفاعل الصبغة الكهروستاتيكية مع مجموعات الأمينو والكربوكسيل من البروتينات، دون تمييز. ترتبط جزيئات الصبغة بالبروتينات بما في ذلك الصوف (الكيراتين) لتشكيل مركب بروتين وصبغ. يؤدي تكوين المعقد إلى تثبيت الشكل الأنيني المشحون سالبة الصبغة المنتجة باللون الأزرق، حتى في ظل الظروف الحمضية عندما تكون معظم الجزيئات في المحلول في شكل كاتيوني. هذا هو أساس اختبار برادفورد وهو طريقة لتحديد البروتينات التي تنطوي على ارتباط الصبغة الزرقاء Coomassie Brilliant بالبروتينات. يؤدي تجليد الصبغة إلى بروتين إلى حدوث تحول في الحد الأقصى للامتصاص للصبغة من 465 إلى 595 نانومتر. تتم مراقبة زيادة الامتصاص عند 595 نانومتر لتحديد تركيز البروتين.
كما تشكل الصبغة معقد مع dodecyl sulfate الصوديوم منظف أنيوني (SDS) تكوين هذا المجمع يثبت الشكل الأخضر المحايد للصبغة. يمكن لهذا التأثير أن يتداخل مع تقدير تركيز البروتين باستخدام اختبار برادفورد. ومن المرجح أيضا أن المنظف أنيوني يتنافس مع صبغة للارتباط للبروتين.
التطبيقات بالكيمياء الحيوية
عدلتم استخدام Coomassie Brilliant Blue R-250 لأول مرة لتصور البروتينات في عام 1964 من قبل Fazekas دي سانت غروث والزملاء. تم فصل عينات البروتين الكهربائي على ورقة خلات السليولوز. ثم تم غمر الورقة في حمض sulfosalicylic لإصلاح أشرطة البروتين ومن ثم نقلها إلى محلول للصبغة.
بعد ذلك بعامين في عام 1965، استخدم ماير ولامبرت Coomassie Brilliant Blue R-250 لصبغ عينات البروتين بعد الفصل الكهربي في هلام بولي أكريلاميد. لقد غمروا الهلام في محلول الصبغة المحتوي على ميثانول وحمض أسيتيك وماء. كما صبغ الصباغ هلام بولي أكريلاميد وكذلك البروتين، من أجل تصور مجموعات البروتين التي يحتاجونها لتدمير الجل الذي فعلوه electrophoretically. أفادت المنشورات اللاحقة أنه يمكن القضاء على هلام بولي أكريلاميد بنجاح باستخدام محلول حمض الأسيتيك.
وجاء التقرير الأول لاستخدام شكل "G" للصبغة لتصور أشرطة البروتين في المواد الهلامية بولي أكريلاميد في عام 1967، حيث تم تذويب الصبغة في محلول حمض الأسيتيك المحتوي على ميثانول. اكتشف لاحقا أنه يمكن تلوين عصابات البروتين دون تلطيخ بولي أكريلاميد باستخدام غرواني من شكل "G" للصبغة في محلول حمض ثلاثي كلوروسيتيك لا يحتوي على ميثانول. باستخدام هذا الإجراء لم يعد من الضروري نزع الجل. تستخدم الصيغ الحديثة عادة غروًا من الصبغة "G" للصبغة في محلول يحتوي على حمض الفوسفوريك أو الإيثانول (أو الميثانول) وكبريتات الأمونيوم (أو كبريتات الألومنيوم).
يستخدم اختبار برادفورد الخصائص الطيفية لـ Coomassie Brilliant Blue G-250 لتقدير كمية البروتين في محلول. يضاف عينة من البروتين إلى محلول الصبغة في حمض الفوسفوريك والإيثانول. في الظروف الحمضية، تكون الصبغة لونًا بنيًا، ولكن عند الارتباط بالبروتين يتم إنتاج الشكل الأزرق للصبغة. يقاس الامتصاص البصري للمحلول بطول موجة 595 نانومتر. الصباغة ملحوظة بسبب مستوى الحساسية العالية، 5 ميكروغرام من البروتين كافية لتمييز الفرق. ومع ذلك، من بين عيوب الطريقة تباين تطور اللون مع بروتينات مختلفة، يتغير تغير الامتصاص لكل وحدة كتلة من البروتينات مع نوع البروتين.
عند الارتباط ببروتين، فإن جزيئة الصبغة Coomassie Brilliant Blue G-250 المشحونة سلبياً تعطي شحنة سالبة إجمالية للبروتين. يمكن استخدام هذه الخاصية لفصل البروتينات أو مجمعات البروتين باستخدام الرحلان الكهربائي للهلام بولي أكريلاميد تحت ظروف عدم تغيير الطبيعة في تقنية تدعى Blue Native PAGE. إن قابلية الحركة المعقدة في هلام بولي أكريلاميد تعتمد على حجم مركب البروتين (أي الوزن الجزيئي) وعلى كمية الصبغة المرتبطة بالبروتين.
ويمكن استخدام تلوث الأزرق Coomassie كطريقة تلطيخ للتحكم في التحميل. تحليل لطخة غربية. يتم تطبيقه كصبغ ما قبل الأجسام المضادة الأيوني.
الاستخدامات الطبية
عدلفي عام 2009، تم استخدام Brilliant Blue G في التجارب العلمية لعلاج إصابات العمود الفقري في الفئران المختبرية. وهو يعمل عن طريق الحد من استجابة التورم الطبيعي للجسم، والتي يمكن أن تسبب الخلايا العصبية في المنطقة للموت بسبب الإجهاد الأيضي.
أثبت الاختبار على الجرذان فعاليته. تم اختبار مجموعتين من الجرذان المصابة، مع إعطاء مجموعة واحدة الصبغة كعلاج لإصابات العمود الفقري ولم تكن المجموعة الأخرى كذلك. أثبتت نتائج الاختبار أنه بالمقارنة مع الفئران التي لم تتلق صبغ، كانت الفئران التي عولجت مع الصبغة قادرة على التحرك بشكل أفضل وقادرة على أداء الفئران دون علاج الصبغة في اختبارات الحركة.
لا يزال الاختبار قيد التنفيذ لتحديد ما إذا كان يمكن استخدام هذا العلاج بفعالية على البشر. أعطت الاختبارات الأخيرة الصبغة في غضون 15 دقيقة من الإصابة، ولكن لكي تكون فعالة في بيئة واقعية، حيث قد يستغرق المريض وقتًا للوصول إلى غرفة الطوارئ، يجب أن يكون العلاج فعّالًا حتى عند تناوله ما يصل إلى ساعتين بعد الإصابة. كان التأثير الجانبي الوحيد الذي تم الإبلاغ عنه هو أن الفئران تحولت إلى اللون الأزرق مؤقتًا. تحت الاسم التجاري Brilliant Peel ، تم استخدام Brilliant Blue G لمساعدة الجراحين في جراحة الشبكية.
التطبيقات في الطب الشرعي
عدلمن خلال دراسة أجريت في جامعة ألباني، تبين أن قدرة صبغة كوماسي على استهداف الأحماض الأمينية مع مجموعات عطرية (فينيل ألانين، تيروزين، تريبتوفان) والسلاسل الجانبية الأساسية (ليسين، أرجينين وحامض الهيستامين)، تسمح اختبار برادفورد ليتم استخدامها لتحليل بصمات الأصابع. تم استخدام اختبار برادفورد بنجاح لتحديد الجنس البيولوجي للبصمة. تبين أن عينات الإناث تحتوي على امتصاص أعلى بالمقارنة مع عينات الذكور التطبيق في علم الطب الشرعي عند اختباره في أطوال موجية مماثلة. وهذا يوفر طريقة أبسط لتحليل بصمات الأصابع من خلال تقليل عدد الأحماض الأمينية اللازمة لتحليلها من 23 إلى 6، ولديها القليل من التحضير للمقايسة، مقارنة بمقايسة الكيماويات نينهدرين التي تتطلب إعداد مقايسة مثل تسخين وإنزيم تتالي.
المراجع
عدل- ^ ا ب ج د Brilliant Blue R (بالإنجليزية), QID:Q278487
- ^ Fox، M. R. (1987). Dye-makers of Great Britain 1856-1976 : A History of Chemists, Companies, Products and Changes. Manchester: Imperial Chemical Industries. ص. 38.
- ^ Colour Index (PDF) (ط. 3rd). Bradford: Society of Dyers and Colourists. ج. 4. 1971. ص. 4397–4398. مؤرشف من الأصل (pdf) في 2019-06-18.
- ^ FR patent 474260, "Procédé de production de colorants de la série du triarylméthane", issued 1915-02-16, assigned to Bayer
- ^ US patent 1218232, Weiler, Max, "Blue Triphenylmethane Dye", issued 1917-03-06
- ^ GB patent 275609, "Manufacture of Triarylmethane-dyestuffs", issued 1927-11-03, assigned to IG Farbenindustrie
| في كومنز صور وملفات عن: كوماسي بريلينت بلو |