مركب كيميائي
المُركب الكيميائي[1] هو مادة كيميائية تكونت من عنصرين أو أكثر،[2][3][4] بنسبة ثابتة تحدد تركيبه، فمثلا الماء (H2O) مركب يتكون من الهيدروجين والأكسجين بنسبة 1:2، وبصفة عامة فإن هذه النسبة يجب أن تكون ثابتة لبعض الاعتبارات الفيزيائية، وليس طبقا للاختيارات البشرية، ولهذا السبب فإن المواد مثل النحاس الأصفر تعتبر سبيكة وليست مركب. ومن الخواص المميزة للمركب أن له بنية كيميائية مميزة يعبر عنها عن طريق صيغة جزيئية، تصف هذه الصيغ نسبة الذرات الموجودة به، وعدد الذرات الموجودة في جزيء واحد من المادة، وعلى هذا فيكون شكل الإيثان C2H6 وليس CH2)، ويمكن عن طريق معرفة تلك الصيغ حساب الكتلة المولية للمركب، توجد عدة معرفات لتمييز المركبات الكيميائية منها رقم CAS (رقم لتعريف كل المركبات).

| |
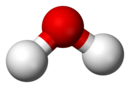
| في اعلى الصورة منظر يوضح خواص مركب الماء النقي، في الأسفل جزئ الماء الذي يتكون من جزءين هيدروجين وجزء واحد اكسجين (H2O) كما يظهر في نموذج الكرات الملصقة ثلاثي الابعاد. |
ويمكن للمركبات أن يكون لها حالات عديدة. معظم المركبات توجد في هيئة صلبة. كما أن المركبات الجزيئية يمكن أن توجد أيضا في حالة سائلة أو غازية.
تعريفات أشمل
عدلهناك استثناءات للتعريف أعلاه حيث يوجد على الأرض عدد كبير من المواد الكيميائية الصلبة ذات الصيغ المعقدة، تسمى بعض المركبات البلورية بالمركبات غير المتكافئة وذلك إما لوجود الشوائب داخل البلورة أو لنقص أو زيادة العناصر المكونة، وتوجد هذه العناصر في قشرة وغلاف الأرض
والمركبات الكيميائية المتكافئة تختلف عن بعض من حيث الوزن والنظائر للعناصر المكونة مما يؤدي إلى اختلاف نسبة العناصر تبعاً لاختلاف الكتلة.
فالمركب : اتحاد عنصرين أو أكثر اتحاداً كيميائياً، ويمكن فصل عناصره بوسائل كيميائية كالطاقة والحرارة
اما العنصر : مادة نقية لا يمكن تجزئتها إلى مواد ابسط منها بوسائل فيزيائية أو كيميائية
مقارنة المركبات والمخاليط
عدلالخواص الفيزيائية والكيميائية للمركب تختلف عن خواص العناصر المكونة لها وهذه إحدى الطرق للتمييز بين خلائط العناصر أو مواد أخرى لانه مزيج من الخصائص بشكل عام ترتبط ببعضها ارتباطا وثيقا وتعتمد على خصائص المكونات.
يتميز الخليط عن المركب أنه يمكن فصل مكوناته بسهولة بطرق ميكانيكية سواء الترسيب أو التبخر أو باستخدام القوة المغناطيسية لكن لايمكن فصل مكونات المركب إلا بالتفاعل الكيميائي.
يمكن تكوين الخليط بطريقة ميكانيكية بينما يتكون المركب (من عنصر أو مركبات أخرى أو مزيج منهما) عن طريق التفاعل الكيميائي.
بعض الخلائط ترتبط ارتبطا وثيقا بالمركبات ولها نفس الخصائص ومن السهل عدم التفريق بينهم ومثال ذلك السبائك
تصنع السبائك بطريقة ميكانيكية حيث يسخن المعدن إلى أن يتحول إلى الحالة السائلة ويخلط جيداً وتعتبر هذه الطريقة أكثر شيوعا ثم يبرد الخليط مع التحريك بسرعة بحيث تكون المكونات بالأسفل مكونة قاعدة معدنية وامثلة أخرى للمركبات كالخلائط تشمل سبائك المعادن والفلزات القلوية المحلولة في الأمونيا السائل.
الصيغة
عدلالصيغة الكيميائية يصف الكيميائيون المركبات الكيميائية باستخدام صيغ مختلفة، فالمركبات الجزيئية يتم عرضها بصيغة جزيئية والمواد البوليمرية مثل المعادن وأكاسيدها تعطى عادة بصيغ تجريبية مثل ملح الطعام NaCl
ويتم عادة ترتيب العناصر حسب تنظيم معين يعرف بنظام هيل
ففي نظام هيل يتم وضع ذرة الكربون في البداية وتوضع أي ذرة هيدروجين بعدها ومن ثم جميع العناصر الأخرى حسب الترتيب الأبجدي إذا كانت الصيغة لاتحوي عنصر الكربون ترتب أبجديا بما في ذلك الهيدروجين، وهناك عدة استثناءات عامة حيث توضع المركبات الأيونية الإيجابية أولا والعناصر الأيونية السلبية تبعا لها وتوضع الأكاسيد آخر قائمة الأكسجين الأحماض العضوية بصفة عامة تتبع القواعد فتدرج أبجديا مع الصيغ المبدوءة بحرف H,C
ومثال ذلك حمض trifluoroacetic ويكتب C2HF3O2حيث يمكن من الصيغة معرفة المعلومات الهيكلية ويمكن كتابة trifluoroacetic بالصيغة CF3CO2H
من ناحية أخرى الصيغ الكيميائية للأحماض غير العضوية والقاعدية تستثنى من القواعد العامة فتكتب وفق قواعد المركب الايوني (الإيجابية أولا والسلبية ثانيا) بما يطابق تعاريف ارهينيس
تبدا صيغ معظم الأحماض غير العضوية القاعدية بـ H ومعظم القواعدتنتهي بأيون الهيدروكسيد(-OH) ولايمكن من صيغ المركبات غير العضوية معرفة معلومات عن البناء الهيكلي كما في حمض الكبريتيك H2SO4 فهو لايحوي الرابطة H-S والصيغة الوصفية له O2S(OH)2 لكنها لاتكتب أبدا هكذا
الطور والخصائص الحرارية
عدلقد يكون للمركب عدة أطوار محتملة. فجميع المركبات توجد في الحالة الصلبة عند درجات منخفضة بما فيه الكفاية. وقد تتواجد في الحالة السائلة أو الغازية وأحيانا توجد في الحالة البلازمية.
وعند تطبيق درجة حرارة معينة تتحلل المركبات وتسمى درجة الحرارة هذه بحرارة التحلل وهي غير حادة وتعتمد على معدل الحرارة.
الرقم CAS
عدلكل مادة كيميائية بما في ذلك المركبات توصف برقم فريد يسمى المعرف العددي وهو العدد رقم التسجيل CAS.
أنواع المركبات
عدلانظر أيضاً
عدلمراجع
عدل- ^ المعجم الموحد لمصطلحات علم الأحياء، سلسلة المعاجم الموحدة (8) (بالعربية والإنجليزية والفرنسية)، تونس: مكتب تنسيق التعريب، 1993، ص. 78، OCLC:929544775، QID:Q114972534
- ^ Brown، Theodore L.؛ LeMay، H. Eugene؛ Bursten، Bruce E.؛ Murphy، Catherine J.؛ Woodward، Patrick (2009)، Chemistry: The Central Science, AP Edition (ط. 11th)، Upper Saddle River, NJ: Pearson/Prentice Hall، ص. 5–6، ISBN:0132364891، مؤرشف من الأصل في 2016-03-27
- ^ Hill، John W.؛ Petrucci، Ralph H.؛ McCreary، Terry W.؛ Perry، Scott S. (2005)، General Chemistry (ط. 4th)، Upper Saddle River, NJ: Pearson/Prentice Hall، ص. 6، ISBN:9780131402836، مؤرشف من الأصل في 2015-09-24
- ^ Whitten، Kenneth W.؛ Davis، Raymond E.؛ Peck، M. Larry (2000)، General Chemistry (ط. 6th)، Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers، ص. 15، ISBN:9780030723735
| في كومنز صور وملفات عن: مركب كيميائي |