قياس التدفق الخلوي
قياس التدفق الخلوي (بالإنجليزية: Flow cytometry) (اختصار: FCM) هي تقنية لعـّد وفحص الجسيمات المجهرية، مثل الخلايا والكروموسومات، عن طريق تعليق تلك الجسيمات في تيار من السوائل وتمريرهم عبر جهاز كشف إلكتروني. تسمح هذه التقنية بإجراء تحليل متعدد العوامل multiparametric ومتزامن للخواص الفيزيائية و/أو الكيميائية لما يصل عدده إلى آلاف من الجزيئات في الثانية الواحدة. يستخدم قياس التدفق الخلوي بشكل روتيني في تشخيص الأمراض، وخاصة سرطان الدم، ولكن له أيضاً العديد من التطبيقات الأخرى في كل من البحث العلمي والممارسة الطبية الاكلينيكية. وهناك تطبيق مختلف لهذه التقنية وهو تقسيم الجسيمات تبعاً لخصائصها وذلك لفصل وتنقية نوع معين منها يلقى الاهتمام.
التاريخ
عدلأول جهاز لقياس التدفق الخلوي قائم على المقاومة (Impedance-based) باستخدام مبدأ كولتر Coulter principle، تم تسجيله في براءات الاختراع في الولايات المتحدة الأمريكية رقم 2656508، صدر في عام 1953، باسم والاس هـ. كولتر. أول جهاز لقياس التدفق الخلوي قائم على الوميض (Fluorescence-based) والمسمى (ICP 11) تم تطويره في عام 1968 بواسطة ولفجانج جوهدى Wolfgang Göhde من جامعة مونستر University of Münster. وتم طرحه بالأسواق في عام 1968/69 بواسطة الشركة الألمانية المُـصَنّعة والمُطًوٍرة بارتك Partec عن طريق شركة فيوي ايه جي Phywe AG في غوتينغن بألمانيا. في ذلك الوقت، كانت الأساليب القائمة على الامتصاص لا تزال مفضلة على نطاق واسع من قبل علماء آخرين عن الأساليب القائمة على الوميض.[1] بعد فترة وجيزة، تم تطوير العديد من أجهزة قياس التدفق الخلوي، بما في ذلك (1971) Cytofluorograph من شركة أنظمة الفيزياء الحيوية.Bio/Physics Systems Inc (لاحقاً Ortho Diagnostics)، وجهاز (PAS 8000 (1973 من شركة Partec، وأول جهاز FACS من بيكتون ديكنسون (Becton Dickinson) (1974)، وجهاز (ICP 22 (1975 من شركة Phywe / Partec وجهاز Epic من شركة كولتر (Coulter (1977-1978.
اسم التكنولوجيا
عدلكان الاسم الأصلي لتكنولوجيا قياس التدفق الخلوي هو القياس الضوئي النابض للخلايا "Pulse Cytophotometry" (بالألمانية: Impulszytophotometrie). فقط بعد 20 عاما في عام 1988، في مؤتمر لمؤسسة الهندسة الاميركية في بنساكولا (فلوريدا، تم تغيير الاسم إلى «قياس التدفق الخلوي»، وهو المصطلح الذي سرعان ما أصبحت له شعبية.
مبدأ قياس التدفق الخلوي
عدليتم توجيه شعاع ضوئي (عادة الليزر) ذو طول موجي أحادي باتجاه سائل متدفق مُـرَكَّـز يحتوي على الجسيمات. يتم توجيه عدد من المجسات (الكواشف) باتجاه النقطة التي يمر بها السائل المتدفق عبر الشعاع الضوئي: مجس واحد بنفس اتجاه الشعاع الضوئي (التَشَتُت الأمامي Forward Scatter or FSC) ومجسات أخرى باتجاه عمودي للشعاع الضوئي (التَشَتُت الجانبي (Side Scatter or SSC) بالإضافة لواحد أو أكثر من مجسات الوميض الفلوري). كل الجسيمات المعلقة بالسائل المتدفق والتي يبلغ حجمها 0.2-150 ميكرومتر تمر عبر الشعاع الضوئي وتقوم بتشتيت الشعاع، كما يتم إثارة المواد الكيميائية الوامضة (fluorescent chemicals) الموجودة في الجسيمات أو التي تعلق بها مما يؤدي إلى انبعاث ضوء ذي أطوال موجية أطول من المصدر الأصلي للضوء المار بالسائل. تلك التركيبة من الضوء المُـشَـتَّـت والضوء الفلورسنتي المنبعث يتم التقاطها بواسطة المجسات، وبتحليل التباينات في السطوع بين المجسات وبعضها (مجس لكل ذروة انبعاث فلورسنتي) يمكن استنتاج أنواع مختلفة من المعلومات عن التركيب الفيزيائي والكيميائي لكل جسيم مار على حدة. يرتبط التشتيت الأمامي (FSC) بحجم الخلية بينما يعتمد التشتيت الجانبي (SSC) على مدى تعقيد التركيب الداخلي للجسيم (أي شكل النواة، وكمية ونوع حـُبَيبات السيتوبلازم أو خشونة الغشاء). بعض أجهزة قياس التدفق الخلوي بالأسواق لم تعد بحاجة إلى الانبعاث الفلورسينتي وتستخدم فقط الضوء المـُشـَتَت للقياس. بعض الأجهزة الأخرى تقوم بتكوين صور للانبعاث الفلورسنتي، والضوء المـُشـَتَت، والضوء المار الخاص بكل خلية.
أجهزة قياس التدفق الخلوي
عدليمكن لأجهزة قياس التدفق الخلوي الحديثة أن تقوم بتحليل عدة آلاف من الجسيمات كل ثانية في وقت حقيقي real time، كما يمكن أن تقوم بفصل وعزل جسيمات ذات خصائص معينة. يشبه جهاز قياس التدفق الخلوي المجهر، غير أنه بدلا من إنتاج صورة من الخلية، يقوم جهاز قياس التدفق الخلوي بعرض معلومات كمية أوتوماتيكية فائقة الإنتاجية "high-throughput" (بالنسبة لعدد كبير من الخلايا) لمجموعة من العوامل.
لتحليل الأنسجة الصلبة، يتم أولاً تحضير مُـعَـلَّق أحادي الخلايا Single-cell suspension.
يحتوي جهاز قياس التدفق الخلوي على 5 مكونات رئيسية وهي:
- تيار سائل للخلايا المتدفقة (السائل الغمد أو الغطائي) والذي يقوم يحمل ومحاذاة الخلايا بحيث تمر كملف واحد عبر الشعاع الضوئي ليتم استشعارها.
- نظام للقياس—الأنظمة التي تستخدم عادة هي قياس المقاومة (أو التوصيل) والنظم البصرية—مصابيح (الزئبق، الزينون)؛ أشعة الليزر عالية الطاقة والمُبَّرَدة مائياً (الأرجون، الكريبتون، ليزر الصبغ)؛ أشعة الليزر منخفضة الطاقة والمُبَّرَدة هوائياً (الأرجون (488 نانومتر)، HeNe الحمراء (633 نانومتر)، الأخضر HeNe، HeCd (الأشعة فوق البنفسجية)؛ ليزر الـdiode (الأزرق والأخضر والأحمر والبنفسجي) والتي تقوم ببعث إشارات ضوئية.
- مجس، ونظام لتحويل الإشارة التناظرية إلى رقمية (Analogue to Digital Conversion or ADC) والذي يقوم بتحويل إشارات التشتت الأمامي والتشتت الجانبي والوميض الفلورسنتي إلى إشارات كهربائية يمكن معالجتها بواسطة الكمبيوتر (رقمية).
- نظام التضخيم—خطياً أو لوغاريتمياً
- كمبيوتر لتحليل الإشارات.
ويطلق على عملية جمع البيانات من العينات باستخدام الجهاز «اكتساب» أو «استحواذ». تتم عملية الاكتساب بواسطة جهاز كمبيوتر متصل بجهاز قياس التدفق الخلوي، بالإضافة إلى البرمجيات التي تقوم بمعالجة الواجهة الرقمية للجهاز (أو الإشارات الرقمية الصادرة عنه). تستطيع البرمجيات ضبط المعلمات (أي الجهد الكهربي، والتعويض، وما إلى ذلك) بالنسبة للعينة التي يجري اختبارها، كما تسهم أيضا في عرض المعلومات الأولية عن العينة في الوقت الذي يتم فيه اكتساب بيانات العينة للتأكد من أن المعلمات تم ضبطها بشكل صحيح. كانت أجهزة قياس التدفق الخلوي في وقت مبكر وبشكل عام مجرد أجهزة تجريبية، ولكن التقدم التكنولوجي سمح بتطبيقها بشكل واسع في العديد من الأغراض البحثية والاكلينيكية. نتيجة لهذه التطورات، تم إيجاد سوق كبير للأجهزة، وبرمجيات التحليل، وكذلك الكواشف (reagents) المستخدمة في الاكتساب مثل الأجسام المضادة المُـعَـلَّـمَة فلورسينتياً (fluorescently-labeled antibodies).
الأجهزة الحديثة عادة ما تحتوي على العديد من أجهزة الليزر ومجسات الوميض الفلورسينتي (السجل الحالي لأحدث جهاز مطروح بشكل تجاري هو 4 أجهزة ليزر و 18 مجس للوميض الفلورسينتي). زيادة عدد أجهزة الليزر والمجسات يسمح بوضع علامات متعددة على الأجسام المضادة، ويُمّكن من تحديد الخلايا المستهدفة بشكل أكثر دقة بواسطة العلامات المظهرية (phenotypic markers) الخاصة بها. يمكن لبعض الأجهزة حتى أن تقوم بأخذ صور رقمية لخلايا متفردة، مما يسمح بتحليل موقع الإشارة الفلورسينتية إما داخل أو على سطح الخلية.
تحليل البيانات
عدلالتبويب
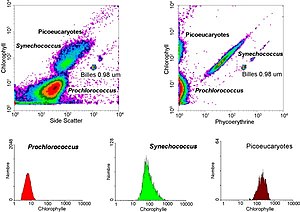
عدليتم رسم البيانات الناتجة عن أجهزة قياس التدفق الخلوي في بُعد واحد، لوضع رسم بياني تكراري (Histogram)، أو في بعدين لوضع خريطة نقطية (dot plots) أو حتى في ثلاثة أبعاد. ويمكن فصل المناطق على تلك الرسومات تباعاً، بالاعتماد على كثافة الوميض الفلورسنتي، من خلال خلق سلسلة من عمليات الاستخراج الفرعية، يطلق عليها «البوابات». هناك بروتوكولات معينة للتبويب موجودة لأغراض تشخيصية واكلينيكية خاصةً فيما يتعلق بأمراض الدم.
غالبا ما يتم وضع الرسومات على جداول لوغاريتمية. نتيجة لأن مجالات الأطياف المختلفة للانبعاث الناتج عن الأصباغ الفلورسنتية تتداخل مع بعضها البعض، [2] فإن الإشارات التي يتم استقبالها بالمجسات يجب تعويضها إلكترونياً وحسابياً. يمكن أن يتم تحليل البيانات المتراكمة عن أجهزة قياس التدفق الخلوي باستخدام برمجيات مثل WinMDI (depricated) [3]، Flowjo، أو CellQuest Pro. وبمجرد جمع البيانات، ليست هناك حاجة للبقاء على اتصال بجهاز قياس التدفق الخلوي. لهذا السبب، فإن التحليل في معظم الأحيان يتم القيام به على كمبيوتر منفصل. وهذا أمر ضروري ولا سيما في المرافق الأساسية حيث يزداد الطلب على استخدام هذه الأجهزة.
التحليل الحسابي
عدلو قد حدث تطور مؤخراً في التعرف على مجموعات الخلايا باستخدام أساليب حسابية مما طرح بديلاً لطرق التبويب التقليدية. ويمكن لأنظمة التعرف الآلية أن تقوم بالكشف عن مجموعات الخلايا النادرة أو المستترة. الأمثلة على تلك الأساليب الآلية تشمل FLOCK في بوابة تحليل وقاعدة بيانات علم المناعة (ImmPort) [4]، FLAME [5] في GenePattern وflowClust [6]، [7]، [8] في Bioconductor. وقد أسفرت الجهود التعاونية عن مشروع مفتوح يسمى FlowCAP (قياس التدفق الخلوي: التقييم النقدي لأساليب التعرف على مجموعات الخلايا، [9]) (Flow Cytometry: Critical Assessment of Population Identification Methods,[18]) ليقوم بتوفير طريقة موضوعية لتقييم ومقارنة أساليب تقسيم بيانات أجهزة قياس التدفق الخلوي، وأيضا لوضع إرشادات حول الاستخدام والتطبيق المناسب لهذه الأساليب.
فرز الخلايا المستحثة بواسطة الوميض الفلورسيني
عدلفرز الخلايا المستحثة بواسطة الوميض الفلورسيني هو نوع متخصص من قياس التدفق الخلوي. وهو يوفر وسيلة لفرز خليط غير متجانس من الخلايا البيولوجية في اثنين أو أكثر من الحاويات، خلية واحدة في كل مرة، استنادا إلى خصائص تشتت الضوء والوميض الفلورسنتي المحددة لكل خلية. يعد جهاز فرز الخلايا المستحثة بواسطة الوميض الفلورسيني أداة علمية مفيدة، حيث أنه يقوم بإجراء رصد سريع وموضوعي وكمي للإشارات الفلورسنتية من الخلايا الفردية، كما يقوم بالفصل المادي لخلايا ذات أهمية خاصة. الاختصار FACS هو علامة تجارية تملكها شركة بيكتون وديكنسون Becton & Dockinson.[10] في حين أن العديد من علماء المناعة يقومون باستخدام هذا المصطلح (FACS) في كثير من الأحيان للإشارة لجميع أنواع تطبيقات قياس التدفق الخلوي سواءً التي تقوم بالفرز أو التي لا تقوم بذلك، غير أنه مصطلح غير عام لقياس التدفق الخلوي. أول جهاز لفرز الخلايا تم اختراعه بواسطة ماك فولويلر Mack Fulwyler في عام 1965، وذلك باستخدام مبدأ كولتر، وهو أسلوب صعب نسبيا ولم يعد يتم استخدامه في الأجهزة الحديثة. وتم توسيع هذه التقنية من قبل لين هيرزينبيرغ Herzenberg Len والذي كان مسؤولا عن إطلاق المصطلح FACS. وقد فاز هيرزينبيرغ Herzenberg بجائزة كيوتوKyoto في عام 2006 عن عمله في قياس التدفق الخلوي.
يتم جريان معلق الخلايا cell suspension في وسط تيار ضيق وسريع التدفق. يتم ترتيب التدفق بحيث يكون هناك فصل كبير بين الخلايا حسب قطرها. تقوم آلية اهتزازية بتكسير تيار الخلايا إلى قطرات متفردة. ويتم تعديل هذا النظام بحيث يتم تقليل احتمالية وجود أكثر من خلية واحدة في كل قطرة. قبل أن يتم تكسير التيار إلى قطرات، فإن الدفق يمر عبر محطة لقياس الوميض الفلورسينتي حيث يتم قياس خاصية الوميض الفلورسينتي ذات الاهتمام لكل خلية. يتم وضع حلقة شحن كهربائي عند نقطة تكسير التيار إلى قطرات. يتم وضع شحنة على الحلقة اعتماداً على كثافة الوميض الفلورسينتي والتي تم قياسها سابقاً ومباشرةً، ويتم وضع شحنة معاكسة (مضادة) على القطرة في لحظة تكسرها عن التيار المتدفق. يتم بعد ذلك إسقاط القطرات المشحونة عبر نظام انحراف كهربائي ساكن والذي يقوم بدوره بتوجيه القطرات إلى حاويات على أساس شحناتها. في بعض الأنظمة، يتم تطبيق هذه الشحنة مباشرة على التيار، وتحتفظ القطرات المتكسرة بنفس شحنة التيار. ثم يتم بعد ذلك نزع الشحنة عن التيار (جعله معادلاً) بعد انكسار القطرات عنه.
الواسمات الوامضة فلورسينياً (Fluorescent Labels)
عدل- المقال الرئيسي: Fluorophore
يمكن استخدام مجموعة واسعة من الجسيمات الفلورية fluorophores كواسمات في قياس التدفق الخلوي. لكل من هذه الجسيمات ذروة إثارة وانبعاث ذو طول موجي مميزين. أيضا، غالباً ما تتداخل أطياف الانبعاث الخاصة بالواسمات. وبالتالي، فإن تركيبة الواسمات التي يمكن استخدامها تعتمد على الطول الموجي للمصباح (أو المصابيح) أو أجهزة الليزر المستخدمة لإثارة الجسيمات الفلورية وكذلك على المجسات المتاحة.[11]
المعلمات القابلة للقياس Measurable Parameters
عدلهذه القائمة طويلة جداً، كما يتم توسيعها باستمرار.
- الحجم والتعقيد المورفولوجي (التركيب الظاهري) للخلايا
- أصباغ الخلية مثل الكلوروفيل Chlorophyll أو الفايكوإريثرين Phycoerythrin
- إجمالي محتوى الحمض النووي الدي أوكسي ريبوزي DNA (تحليل دورة الخلية، حركية الخلية، الانقسام، إلخ.)
- إجمالي محتوى الحمض النووي الريبوزي RNA
- التباين في عدد نسخ الحمض النووي الدي أوكسي ريبوزي DNA (من خلال Flow-FISH)
- تحليل وفرز الكروموسومات (تكوين مكتبة، وطلاء كروموسوم)
- الكشف عن ترجمة بروتين ما وتحديد مكانه
- تعديلات البروتينات البروتينات المفسفرة (Phospho-proteins).
- المنتجات المعدلة وراثيا في الأحياء ، وخاصة البروتينات الفلورية الخضراء أو الفلورسنت ذات الصلة
- مستضدات سطح الخلايا Cell Surface Antigens (علامات كتلة التمايز (Clusters of Differentiation - CD))
- المستضدات بين الخلاياIntracellualr Antigens (كيمياويات خلوية متنوعة cytokines ووسائط ثانوية، إلخ.)
- المستضدات النووية Nuclear Antigens
- نَشَاطٌ إنْزِيْمِيّ
- الرقم الهيدروجيني، الكالسيوم المتأين بين الخلايا والمغنيسيوم وكهربية الغشاء
- سيولة الغشاء
- موت الخلايا المبرمج apoptosis (القياس الكمي، وقياس تحلل الحمض النووي، وكهربية غشاء الميتوكوندريا، والتغيرات النفاذية ونشاط الـcaspase)
- سلامة الخلايا Cell viability
- رصد النفاذية الكهربية للخلايا electropermeabilization
- الجهد المؤكسد Oxidative burst
- وصف المقاومة المتعددة للأدوية (MDR) في الخلايا السرطانية
- الجلوتاثيون Glutathione
- تركيبات مختلفة (المستضدات السطحية الحمض النووي /، إلخ.)
- الالتصاق الخلوي (على سبيل المثال الالتصاق بين الجزيء المسبب للممرض والخلية المصابة)
التطبيقات
عدللهذه التكنولوجيا تطبيقات في العديد من المجالات، بما في ذلك البيولوجيا الجزيئية وعلم الأمراض، وعلم المناعة، وعلم الأحياء النباتية والأحياء البحرية. كما أن لها تطبيقاً واسعاً في الطب (وخاصة في زراعة الأعضاء، أمراض الدم، علم مناعة الأورام والعلاج الكيميائي وعلم الوراثة والجينات، وفرز الحيوانات المنوية لاختيار الجنس مسبقاً). في علم الأحياء البحرية يمكن استغلال خصائص الوميض الفلورسينتي الذاتي في عوالق التمثيل الضوئي بواسطة أجهزة قياس التدفق الخلوي من أجل تحديد مدى وفرة تلك العوالق الهيكل البنائي لمجتمعاتها. في مجال هندسة البروتين، يتم استخدام قياس التدفق الخلوي بالتزامن مع عرض الخميرة والعرض البكتيري لتحديد تنوعات من بروتينات السطح المعرضة cell surface- displayed proteins ذات خصائص مرغوبة. كما أنها تستخدم لتحديد عدد مجموعات الكروموسومات في سمك الشبوط العشبي grass carp fry.
قراءات
عدل- أول مبادئ قياس التدفق الخلوي من قبل أليس جيفان Alice Givan Longobardi. ISBN 0-471-38224-8
- قياس التدفق الخلوي عملياً بواسطة هوارد م. شابيرو Howard M. Shapiro. ISBN 0-471-41125-6
- قياس التدفق الخلوي للتكنولوجيا الحيوية من قبل سكلار أ. لاري Larry A. Skla. ISBN 0-19-515234-4
- كتيب طرق قياس التدفق الخلوي من قبل ج. بول روبنسون ياء، وآخرون. ISBN 0-471-59634-5
- البروتوكولات الحالية في القياس الخلوي ، منشورات وايلي - ليس Wiley-Liss Pub. ISSN 1934-9297ISSN 1934-9297
- قياس التدفق الخلوي في التشخيص السريري ، v4، (كاري، مكوي، وكيرين، محرران) مطبوعات ASCP، 2007 (Carey, McCoy, and Keren, eds), ASCP Press, 2007. ISBN 0-89189-548-5
- Ormerod, M.G. (ed.) (2000) قياس التدفق الخلوي—اتباع نهج عملي. الطبعة الثالثة. مطبعة جامعة أكسفورد، أكسفورد، المملكة المتحدة. ISBN 0-19-963824-1
- Ormerod, M.G. 1999) قياس التدفق الخلوي. الطبعة الثانية. الناشرين العلميين BIOS أكسفورد. ISBN 1-85996-107-X
- قياس التدفق الخلوي—مقدمة أساسية. مايكل ج. اورميرود، Michael G. Ormerod 2008. ISBN 978-0-8046-8075-2
المراجع
عدل- ^ Kamentsky، وقائع المؤتمر أتمتة علم الخلية "" في إدنبرة، 1970
- ^ "Fluorochrome Table". مؤرشف من الأصل في 2014-10-20.
- ^ "TSRI Cytometry Software Page". مؤرشف من الأصل في 2016-08-25. اطلع عليه بتاريخ 2009-09-03.
- ^ "Immunology Database and Analysis Portal". مؤرشف من الأصل في 2012-01-22. اطلع عليه بتاريخ 2009-09-03.
- ^ "FLow analysis with Automated Multivariate Estimation (FLAME)". مؤرشف من الأصل في 2015-01-28. اطلع عليه بتاريخ 2009-09-03.
- ^ "flowClust". مؤرشف من الأصل في 2017-06-13. اطلع عليه بتاريخ 2009-09-03.
- ^ Automated gating of flow cytometry data via robust model-based clustering - Lo - 2008 - Cytometry Part A - Wiley Online Library [وصلة مكسورة]
- ^ flowClust: a Bioconductor package for automated gating of flow cytometry data | BMC Bioinformatics | Full Text نسخة محفوظة 23 سبتمبر 2015 على موقع واي باك مشين.
- ^ "FlowCAP - Flow Cytometry: Critical Assessment of Population Identification Methods". مؤرشف من الأصل في 2019-04-10. اطلع عليه بتاريخ 2009-09-03.
- ^ "FACS MultiSET System" (PDF). Becton Dickinson. مؤرشف من الأصل (PDF) في 2006-10-16. اطلع عليه بتاريخ 2007-02-09.
- ^ Loken MR (1990). "Immunofluorescence Techniques in Flow Cytometry and Sorting" (ط. 2nd). Wiley: 341–53.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة)
وصلات خارجية
عدل- قياس التدفق الخلوي -- كيف يعمل؟
- دروس في الوميض الفلورسيني وقياس التدفق الخلوي
- Flow+cytometry في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- محاضرات باور بوينت عن قياس التدفق الخلوي
- كيف يعمل قياس التدفق الخلوي
- Fluorophores.org -- قاعدة بيانات من الأصباغ الفلورية
- جدول fluorochromes
- عارض أطياف الوميض الفلورسيني - جافا
- قياس التدفق الخلوي المُجَّمَّـع لاثنين من أسطح الخلايا،
- جمعية القياس الخلوي السريرية
- ويكي للتدفق السريري
- قياس التدفق الخلوي عالي المخرجات high throughput
- [1] قياس التدفق الخلوي السهل الوصول
- FICCS—مجتمع معلوماتية التدفق وحوسبة القياس الخلوي
- Amnis صور الخلايا في التدفق.
- Coulterflow أدوات قياس التدفق الخلوي.
- بحوث بلوسكاي ليزرات قياس التدفق الخلوي.
- عارض أطياف الوميض الفلورسينتي SpectraViewer {/0 }—التحقق من مدى توافق الجسيمات الفلورية الخاصة بك عند تصميم تجارب متعددة الألوان.
- اقرأ المزيد عن قياس التدفق الخلوي