حمض أسيتو الأسيتيك
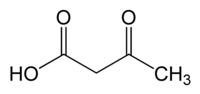
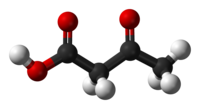
حمض أسيتو الأسيتيك[5][6] أو حامض أسيتو أستيك[5] هو مركب عضوي صيغته الكيميائية C4H6O3 التي يمكن كتابتها على الشكل CH3COCH2COOH، ويوجد في الشروط القياسية على شكل سائل لزج عديم اللون.
| حمض أسيتو الأسيتيك | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
3-Oxobutanoic acid[1] |
|
| أسماء أخرى | |
Acetoacetic acid (no longer recommended[1]) |
|
| المعرفات | |
| رقم CAS | 541-50-4 |
| بوب كيم | 96 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C4H6O3 |
| الكتلة المولية | 102.09 غ/مول |
| المظهر | سائل عديم اللون |
| نقطة الانصهار | 36–37 °س |
| حموضة (pKa) | 3.58 [4] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
يصنف المركب ضمن مشتقات الأحماض الكربوكسيلية، فهو أبسط أحماض كيتو، ويسمى ملحه أسيتو الأسيتات.
التحضير
عدليمكن تحضير المركب من حلمهة (تحلل مائي) الإستر أسيتو أسيتات الإيثيل في وسط حمضي؛ ويحضر الأخير من أسيتات الإيثيل بوجود الصوديوم وفق تكاثف كلايزن:[7]
كما يمكن أن تتم عملية التحضير عن طريق أكسدة حمض الزبدة (حمض البوتيريك) باستخدام فوق أكسيد الهيدروجين (الماء الأكسجيني):
في طريقة أخرى للتحضير، يحصل على المركب من تفاعل ثنائي الكيتين مع الكحولات.[8]
الخواص
عدليوجد حمض أسيتو الأسيتيك في الشروط القياسية على شكل سائل لزج عديم اللون. يخضع المركب إلى تصاوغ كيتو-إينول الصنوي، ويثبت الشكل الإينولي جزئياً بسبب الترافق وبسبب الرابطة الهيدروجينية داخل الجزيء. يعتمد انزياح التوازن الكيميائي على نوع المذيب المستخدم؛ حيث يسود شكل الكيتو في المذيبات القطبية، والشكل الإينولي في المذيبات اللاقطبية.[9]
يتفكك حمض أسيتو الأسيتيك في تفاعل نزع كربوكسيل عند التعرض لدرجات حرارة مرتفعة (أعلى من 100 °س) وذلك إلى الأسيتون وثنائي أكسيد الكربون:
يتفاعل المركب مع الهالوجينات، مثل عنصري الكلور أو البروم ليعطي كلورو الأسيتون أو برومو الأسيتون على الترتيب:
الاستخدامات
عدليستخدم حمض أسيتو الأسيتيك في تحضير صباغ أصفر الأريليد (Arylide yellow) وخضاب ثنائي الأريليد.[8]
كما يستخدم المركب في الاصطناع العضوي لتحضير مشتقات أسيتو الأسيتات، كما هو الحال في المثال التالي، حيث يحصل على مشتق أسيتو الأسيتات لمركب 2-أمينو الإندان.[10]
المراجع
عدل- ^ ا ب Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ص. 748. DOI:10.1039/9781849733069-FP001. ISBN:978-0-85404-182-4.
- ^ ا ب ج acetoacetic acid (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Robert C. Weast (1988). Robert C. Weast (ed.). CRC Handbook of Chemistry and Physics (1st student edition) (بالإنجليزية) (1st ed.). CRC Press. ISBN:978-0-8493-0740-9. OL:2397021M. QID:Q23576506.
- ^ ا ب محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 5، OCLC:4769982658، QID:Q126042864
- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 9، OCLC:931065783، QID:Q113378673
- ^ F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 591. Volltext نسخة محفوظة 16 يناير 2017 على موقع واي باك مشين.
- ^ ا ب Franz Dietrich Klingler؛ Wolfgang Ebertz (2005). "Oxocarboxylic Acids". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a18_313.
- ^ Grande، Karen D.؛ Rosenfeld، Stuart M. (1980). "Tautomeric equilibriums in acetoacetic acid". The Journal of Organic Chemistry. ج. 45 ع. 9: 1626–1628. DOI:10.1021/jo01297a017. ISSN:0022-3263.
- ^ Kiran Kumar Solingapuram Sai؛ Thomas M. Gilbert؛ Douglas A. Klumpp (2007). "Knorr Cyclizations and Distonic Superelectrophiles". J. Org. Chem. ج. 72 ع. 25: 9761–9764. DOI:10.1021/jo7013092. PMID:17999519.
| حمض أسيتو الأسيتيك في المشاريع الشقيقة: | |
| |