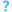يرسينيا القولون
يرسينيا القولون | |
|---|---|
 |
|
| المرتبة التصنيفية | نوع |
| التصنيف العلمي | |
| فوق النطاق | حيويات |
| مملكة عليا | حيويات |
| مملكة | بكتيريا |
| مملكة | Pseudomonadati |
| شعبة | زائفات |
| طائفة | متقلبات غاما |
| رتبة | معويات |
| فصيلة | يرسنيات |
| جنس | يرسينية |
| الاسم العلمي | |
| Yersinia enterocolitica | |
| تعديل مصدري - تعديل | |
يرسينيا القولون (بالإنجليزية يرسينيا القولون) هي بكتيريا عصوية سالبة لصبغة جرام، تنتمي لعائلة البكتيريا المعوية. وهي قادرة على الحركة على درجات الحرارة بين 22-29 درجة مئوية لكنها تفقد قدرتها على الحركة على درجة حرارة جسم الإنسان الطبيعية.[1][2] ي.انتيروكوليتيكا تسبب عدة أمراض للإنسان، تتراوح شدتها بين تلك التي لا تظهر أعراض على المريض إلى أعراض تهدد الحياة خاصة عند الأطفال[3] حيث تتراوح نسبة المصابين من عمر 5 إلى 15 حوالي 75% ومن الأمراض التي تسببها برسينيا الامعاء؛ داء اليرسنيات وهو أحد الأمراض التي تنقلها الحيوانات ويصيب الإنسان، الماشية، الغزلان، الخنازير والطيور. العديد من الحيوانات التي تصاب بهذا المرض تتعافى وتصبح حاملة له وبالتالي مصدر للعدوى بالرغم من عدم اظهارهم أعراض المرض.وتسبب ال ي.انتيروكوليتيكا المرض عن طريق الالتصاق بخلايا العائل باستخدام (trimeric autotransporter adhesins TAAs). يتضمن جنس يرسينيا 11 فصيلة، من بين هذه الاصناف فقط ي.بيستيس وي.سودوتبركيولوسيس وبعض سلالات ال ي.انتيروكوليتيكا تسبب الأمراض للإنسان وبعض الحيوانات ذات الدم الحار، بينما باقي الاصناف من اصول بيئية ومن الممكن ان تتصرف كطفيليات انتهازية. مع ذلك، سلالات اليرسينيا يمكن أن تفصل من مواد عيادية، لذلك يجب تحديدها على مستوى الصنف:
- ي.بيستيس
- ي.سودوتبركيولوسيس
- ي.انتيروكوليتيكا
- ي.فريدريكسيني
- ي.انتيرميديا
- ي.كريستينسيني
- ي.بيركوفيري
- ي.مولاريتي
- ي.رودي
- ي.الدوفاي
- ي.روكيري.
تعتبر بكتيريا «يرسينيا القولون» مجموعة غير متجانسة، تقسم إلى عدد كبير من المجموعات. وتصنف بيولوجياً حسب قدرتها على تأييض المواد العضوية إلى ستة مجموعات، وحسب التصنيف المصلي (نمط مصلي) إلى أكثر من 57 مجموعة O مصلية، على اساس امتلاكهم مولد الضد LPS بالإنجليزية (lipopolysaccharide). تعتبر خمسة من اصل الست مجموعات البيولوجية من مسببات الأمراض، غير أن عدد قليل من السلالات المصلية ارتبط بالامراض سواء في الإنسان أو الحيوان. من المحبذ ذكره بأنه لايمكن ضمَ جميع العينات التي تم عزلها من المياه والتربة إلى المجموعات البيولوجية المسببة للامراض، ذلك لافتقارها للمسببات المرضية الموجودة في المجموعات (1B-5). على نقيض ذلك، يمكن الحصول على سلالة «يرسينيا القولون» من النوع البيولوجي 1A من المياه العذبة بالرغم من كون بعضها مسؤول عن الالتهابات المعوية.
تم عزل السلالات المصلية (3,5,8,9,27) من عينات بشرية من جميع انحاء العالم. فقد تم الكشف عن أهم سلالة مصلية في العديد من البلدان الأوروبية وهي المصلية O: 3 تليها O: 9، في حين أنه تم الكشف بشكل رئيسي عن السلالة المصلية 8 O: في الولايات المتحدة.
تم إضافة تصنيفات أخرى بناءً على: نوع الفاجات البكتيرية، multienzyme electrophoresis، وتم التعرف أيضا على 18 نوع على الأقل من مولدات الضد السوطية (H) في بكتيريا «يرسينيا القولون». من الامثلة عليها (a,b; b,c; b,c,e,f,k; m; etc) [4]
تنتشر بكتيريا «يرسينيا القولون» بشكل واسع في الطبيعة، حيث يمكن ايجادها في التجويف المعوي في العديد من الثدييات، بعض أنواع الطيور وذوات الدم البارد، وحتى في المنافذ البرية والمائية مع العلم أن معظم العينات التي تم عزلها من الطبيعية كانت لسلالات غير مسببة للأمراض. الا أن العينات التي تم عزلها من الخنزير تحتوي على السلالات المسببة للأمراض للإنسان. وبالإضافة إلى ذلك، تعتبر الكلاب، الأغنام والقوارض البرية مخزونا من سلالات يرسينيا القولون الممرضة،[5] التي غالباً ما تصيب أمعاء الإنسان مسببة التهاب الجدار المعوي والغشاء المخاطي المبطن للأمعاء الدقيقة والغليظة. كما يُمكن أن تؤدي إلى تورم العقد الليمفاوية الموجودة في الأمعاء الدقيقة والتهابها.
تاريخ انتشار المرض
عدلعلى الرغم من الانتشار الكبير لیرسینیا القولون في الطبیعة ونموها في اللحوم وتأقلمها مع درجة حرارة الثلاجة، إلا أن حالات الإصابة بها قليلة. وقد تم إرجاع سبب معظم هذه الإصابات إلى استهلاك الحليب غير المبستر. ففي سبعينات القرن الماضي أكبر حالتي انتشار للیرسینیات حصلتا في 138 طالب في كندا بعد شرب حليب غير مبستر وفي نیویورك حیث أصيب 217 شخصا بهذه العدوى بعد شرب حليب كان قد تلوث بعد بسترته. في ال 1981 انتشرت یرسینیا القولون بین 35 % من 455 شخصا كانوا يقطنون في مخيم لتخفيف الوزن، وتم إرسال 7 منهم إلى المشفى وتم استئصال الزائدة الدودية ل 5 من هؤلاء المصابين. وقد تم إرجاع سبب الإصابة إلى حليب مجفف، كان على الأرجح قد تلوث خلال عملية تحضيره للاستهلاك.[4] وانتشر الیرسینیات الناتج عن الطعام الملوث بیرسینیا القولون بين حزيران وآب عام 1982 في ولاية تينيسي في الولايات المتحدة الأمریكیة،[6] حیث تم تشخيص أكثر من 172 حالة إصابة بهذه البكتيريا، وكانت 41 % من هذه الحالات في الأطفال دون الخامسة سنا. وفقا لإحصاءات انتشار هذا المرض تم ربط الحليب المبستر كحامل لیرسینیا القولون على الرغم من عدم إمكانية عزل البكتيريا من داخل الحلیب. ولكن وجد نفس صنف البكتيري المسبب للإصابة على صندوق نقل حلیب في مزرعة خنازير، حیث كان يتم إطعام الخنازير الحليب منتهي الصلاحية من مصنع الحليب المتورط بالقضية. وفي حالة إعادة استخدام هذه الصناديق دون التعقيم المناسب فمن الممكن أن تنتقل هذه البكتيريا إلى خارج علب الحليب المرسلة للمستهلكين.وللأسف، فإن أعراض الإصابة بیرسینیا القولون مشابهة لأعراض التهاب الزائدة الدودية، وفي ذلك العام تم استئصال الزائدة الحدودیة لأكثر من 17 مریض دون الحاجة لذلك.[4]
صفاتها
عدلیرسینیا القولون من البكتيريا التي تستطيع النمو في درجات الحرارة تحت ال 4° على الرغم من كون درجة الحرارة المثلى لنموها بین ال 28 ° وال 30 °. فعلى درجات الحرارة بين الـ 28 ° و 30 ° تنقسم البكتيريا بمعدل مرة كل 34 دقيقة، وتقل إلى معدل مره كل ساعه عند الـ22 ° وكل 5 ساعات عند الـ 7 ° و 40 ساعة عند ال 1°. فتستطيع هذه البكتيريا احتمال درجات حرارة التجمد لفترات طویلة، والتجميد والانصهار المتتالي، ولكنها تفضل درجة حرارة الغرفة ودرجة حرارة الثلاجة أكثر من درجات الحرارة الواقعة بين هاتين الدرجتين. كما أن یرسینیا القولون موجودة في الأكل المطبوخ أكثر من الني بسبب زیادة كمية المواد المغذية المتوفرة في الطعام المطبوخ، حیث يتضاعف عدد الخلايا البكتيرية الحية داخل لحم العجل أوالخنزير المطبوخ ملیون ضعف خلال 24 ساعة على درجة حرارة 25 °. وعلى الرغم.من هذا كله فیرسینیا القولون حساسة للحرارة، حيث تموت بسهولة في عملية البسترة على درجة حرارة 71.8 ° ل 18 ثانية أو 62.8 ° ل 30 دقیقةّ درجة الحموضة المثالية لیرسینیا القولون هي 7.6 ولكنها تنمو في درجات حموضة تتراوح بين ال 4 وال 10، فهي تستطيع احتمال البیئة القاعدية وتتعايش معها ولكن احتمالها للبیئات الحمضية أقل ويعتمد على درجة الحموضة ودرجة حرارة البيئة والمواد المتوفرة. بالحموض العضویة مثل حمض اللاكتيك وحمض الخليك تؤثر عليها بشدة. كما وتتأثر الیرسینیا بالأشعة فوق البنفسجية ودرجات الملوحة التي تزيد عن الـ 5%.[4]
العلامات والأعراض
عدلبوابة دخول هذه البكتيريا إلى الجسم هي القناة الهضمية. يصاب الإنسان بهذا النوع من البكتيريا عن طريق تناول لحم الخنزير الغير مطبوخ جيداً أو عن طريق اللحوم أو الحليب أو المياه الملوثة. وعادة ما تؤدي التهابات اليرسينيا انتيروكوليتيكا إلى الحد الذاتي من التهاب الأمعاء المعتدل أو التهاب منطقة اللفائفي في الأمعاء الدقيقة أو التهاب الغدد اللمفية في البشر. قد تتضمن الأعراض الإسهال المائي أو الدموي والحمى، تشبه التهاب الزائدة الدودية أو داء السالمونيلا أو داء الديزنطاريا. بعد الامتصاص عن طريق الفم، تتضاعف أنواع اليرسينيا في منطقة اللفائفي وتغزو العقد اللمفاوية في الأمعاء الدقيقة. من هنا يمكن أن تقوم بنشرها إلى العقد اللمفية المساريقي وهذا يؤدي إلى تضخم العقد اللمفية. هذا الوضع يمكن الخلط بينه وبين التهاب الزائدة الدودية لذلك يسمى التهاب الزائدة الدودية الكاذب. في الأشخاص عديمي المناعة، يمكن أن تنتشر من الأمعاء إلى الكبد والطحال مكونة خراجات. ولأن أنواع اليرسينيا هي بكتيريا مُحبة للحديد، الأشخاص المصابين بداء ترسب الحديد العالي الوراثي (هو داء ينتج عن مستويات الحديد العالية في الجسم)، هم أكثر عرضة للعدوى باليرسينيا. وفي الواقع، الملوث الأكثر شيوعاً للدم المخزن هو بكتيريا يرسينيا القولون [7].
داء اليرسينيات يُمكن أن يتسبب أيضاً في الإصابة بالتهاب المفاصل الارتكاسي، موضحاً أن هذا الالتهاب يصيب مفاصل الركبتين وكاحل القدم بشكل خاص، وتظهر الإصابة به في صورة احمرار وسخونة وتورم في موضع الإصابة مع الشعور بآلام وتراجع القدرة على الحركة. ولكن غالباً ما تتلاشى هذه الأعراض في غضون مدة تتراوح من شهر وأربعة شهور على أقصى تقدير، ولكن لا تتوقف عواقب الإصابة بداء اليرسينيات عند هذا الحد، حيث أوضح مارتن آبفيلباخر، مدير المعهد الطبي لعلم الأحياء الدقيقة وعلم الفيروسات والاشتراطات الصحية التابع لمستشفى هامبورغ إيبندورف الجامعي أن الإصابة بهذا المرض يُمكن أن تؤدي إلى حدوث مضاعفات خطيرة كالإصابة بالتهاب السحايا والتهاب عضلة القلب وتسمم الدم، والتي قد تنتهي بالوفاة. كما يُمكن أن تؤدي هذه البكتيريا أيضاً إلى الإصابة بأمراض المناعة الذاتية، مثل التهاب الخلايا الدهنية تحت الجلد والذي تظهر أعراضه في صورة عقد حمراء اللون مصحوبة بآلام مبرحة [8].
فالتهاب الأمعاء أكثر أشكال يرسينيا القولون شيوعا، وغالبا ما يصيب الأطفال من عمر 24 شهرا وتستمر فترة الحضانة للمرض من 4-6 أيام. تتضمن الأعراض الأولية الكسل، وفقدان الشهية، والصداع تتبع إسهال مخاطي مائي يستمر من يوم إلى ثلاثة اسابيع، حمى، مغص وبراز مصحوب بدماء وكريات دم بيضاء. معظم الحالات تتعافى من تلقاء نفسها بدون أضرار بعيدة المدى على المصاب، إلا أن بعض الأطفال الاصغر من ثلاثة أشهر قد يصابون بتجرثم الدم.
تتضمن مضاعفات التهاب الأمعاء التهاب الزائدة الدودية، تقرحات، والتهاب الأمعاء الدقيقة والقولون، التهاب الصفاق (البريتون)، التهاب السحايا، انغماد الامعاء (الانغلاف المعوي) التهاب الأقنية الصفراوية الحاد (الصاعد).[9]
على الرغم من أنه نادراً ما يتم عزل اليرسينيا خارج الأمعاء، يبدو أنه ليس هناك أنسجة لا يمكن أن تنمو فيها، وتشمل العوامل التي قد تجعل الفرد أكثر عرضة لجرثومة اليرسينيا، انخفاض وظيفة المناعة، وسوء التغذية وأمراض الكلى المزمنة وأمراض الكبد، إدمان الكحول، ومرض السكري، والحد الزائد من الحديد . يمكن أن يؤدي انتشار الكائن في الجسم لمختلف الأمراض، بما في ذلك الخراجات والإصابات المرتبطة بالقسطرة، وأمراض القلب، والتهاب السحايا. وقد وصل معدل الوفيات بسبب بكتيريا اليرسينيا بين 30 و 60 في المائة.[4]
الأسباب
عدلغالبا ما يشار إلى لحم الخنزير بأصابع الاتهام كمصدر للعدوى، حيث يعتبر الخنزير الحيوان الوحيد الذي يستهلكه الإنسان ويوفر مأوى لأسباب يرسينات القولون. توجد خاصية مهمة للبكتيريا وهي قدرتها على التضاعف في درجات حرارة تقترب من الصفر السيليزي وبالتالي في الأطعمة المثلجة. تظهر مُمرِضات serovars (بشكل رئيسي: O:3 وO:5 و27 وO:8 وO:9) توزيعا جغرافيا متفاوتا. على أي حال، ظهور سلالات من serovars O:3 و O:9 في أوروبا واليابان في عام 1970 وفي أمريكا الشمالية عند نهاية الثمانينات وهو مثال على الوباء العالمي. هناك احتمالية خطر ممكن لالتهاب المفاصل التفاعلي الذي يتبع العدوى الناتجة عن يرسينا القولون.
العلاج
عدلالیرسینیا بالعادة تحد من نمو نفسها بنفسها ولا تحتاج لعلاج. ولكن في حالات الالتهابات الحادة ينصح بأخذ المضاد الحيوي الدوكسیسایكلین بالإضافة إلى الأحد المضادات من عائلة الأمینوغلیكوزید، خاصة إذا كانت الحالة تصاحب تثبیط مناعي. ومن المضادات الحیویة الأخرى التي تعمل بفعالية ضد یرسینیا القولون هي التراي میثوبریم/سلفامیثوكسازول والسیفتریاكسون والكلورامفینیكول. ومن الجدير بالذكر أن هذه البكتيريا مقاومة للبنسلين ج والامبیسلین والسیفالوتین بسبب إنتاجها انزيم البيتا-لاكتاميز.[10]
تقدم المرض
عدلفي بعض الاحیان یتبع التهاب یریسینا انتیروكولیتیكا التهابات مزمنة مثل التهابات المفاصل، أو التهابات الحمى العقدية أو التهاب المفاصل التفاعلي والذي يكون سببه على الأرجح خلل في جهاز المناعة . في بعض الأحيان يصاب المصاب بمناعة ذاتیة للمفاصل أي أن جهازه المناعي يقوم بمهاجمة مفاصله، والذي يشابه ما يصاب به الإنسان عند الإصابة بالسالمونيلا، شیجیلا وكامبيلوباكتر أو شالمیدیا .[11][12] لكن هذه الحالة ليست مفهومة بشكل جید، وهي تصيب الإناث والذكور بشكل متساوي ويصاب الإنسان بالمناعة الذاتية للمفاصل عادة بعد الإصابة بالإسهال بمدة اسبوع أو اسبوعين ويتراوح مدة استمرار هذا الاتهاب من یوم إلى 38 یوم، وعادة ما تهاجم مفاصل الركبة، الكاحل، اصابع القدم، اصابع اليد، الرسغ وكوع اليد، وتدوم لمدة شهر أو اقل .[4][13][14]
و كذلك في بعض الاحیان یصاحب التهاب یریسینا انتیروكولیتیكا مرض الجریفز ومع أن الدلائل على أن التهاب یریسینا انتیروكولیتیكا هي التي تؤدي إلى مرض الجریفز ضعیفة إلا أنه يوجد ما يدل على أن علاقته به غیر مباشرة، أي أن یریسینا انتیروكولیتیكا لیس من مسببات المرض بل قد یكون أحد عوامل الإصابة به عند الفئة من الناس الذين تتوافر لديهم القابلية حسب جيناتهم.[15] وكذلك تم رفض علاقة التهاب یریسینا انتیروكولیتیكا بامراض الغدة الدرقية حيث كان يعتقد بالسابق إن التهاب یریسینا انتیروكولیتیكا هو أحد المسببات والعوامل لامراض الغدة الدرقية ولكن المثبت الآن هو ان علاقتها معتمدة على وجود قابلية جینیة لدى المصابين تمكن التهاب یریسینا انتیروكولیتیكا بالتمهید لامراض الغدة الدرقیة وان علاقتهما لیست مباشرة ولیست سببیة كذلك.[16][17][18]
المراجع
عدل- ^ Kapatral, V.; Olson, J. W.; Pepe, J. C.; Miller, V. L.; Minnich, S. A. (1996-03-01). "Temperature-dependent regulation of Yersinia enterocolitica Class III flagellar genes". Molecular Microbiology. 19 (5): 1061–1071
- ^ Yersinia spp. | MicrobLog: Microbiology Training Log". microblog.me.uk. Retrieved 2016-02-10.
- ^ Collins FM (1996). "Pasteurella, and Francisella". In Barron S; et al. Barron's Medical Microbiology (4th ed.). University of Texas.
- ^ ا ب ج د ه و Montville, Thomas J., Matthews, Kart R. (2008), “Food microbiology an introduction”, 2nd edition, 141-149
- ^ "Yersinia enterocolitica: pathogenesis، virulence and antimicrobial resistance". Enferm. Infecc. Microbiol. Clin. 30 (1): 24–32
- ^ “Epidemiologic Notes and Reports Multi-State Outbreak of Yersiniosis” (1998, 08, 05).Retrieved from https://www.cdc.gov/Mmwr/preview/mmwrhtml/00001162.htm
"نسخة مؤرشفة". مؤرشف من الأصل في 2021-03-18. اطلع عليه بتاريخ 2021-04-24.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Goljan, Edward F. Rapid Review Pathology. Second Edition. Page 279, Table 15-1
- ^ http://www.aljazeera.net/news/healthmedicine/2013/1/29/%D8%A8%D9%83%D8%AA%D9%8A%D8%B1%D9%8A%D8%A7-
- ^ .Khan.z.z(2015,October,20th) . Yersinia Enterocolitica Clinical Presentation. Retrived from http://emedicine.medscape.com/article/232343-clinical?pa=gpaFAAXxarID7eI2LGLoli%2BS94Kd1GermIpilDpC7vwH3Fwk9J4EE1uKE3bJIUKDIOxOnHyQx%2BKXpHIFkTBYIl%2FDMAtBBAsM6eN9kpLn%2Fas%3D.html
- ^ Bottone, Edward (April 1997). "Yersinia enterocolitica: the charisma continues". Clinical Microbiology Reviews. American Society for Microbiology. 10 (2): 257–276.
- ^ Benvenga S, Santarpia L, Trimarchi F, Guarneri F (2006). "Human Thyroid Autoantigens and Proteins of Yersinia and Borrelia Share Amino Acid Sequence Homology That Includes Binding Motifs to HLA-DR Molecules and T-Cell Receptor". Thyroid
- ^ Toivanen P, Toivanen A (1994). "Does Yersinia induce autoimmunity?". Int Arch Allergy Immunol.
- ^ Ryan KJ; Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill.
- ^ Hansen P, Wenzel B, Brix T, Hegedüs L (2006). "Yersinia enterocolitica infection does not confer an increased risk of thyroid antibodies: evidence from a Danish twin study". Clin Exp Immunol. نسخة محفوظة 14 مارس 2020 على موقع واي باك مشين.
- ^ Hill Gaston JS, Lillicrap MS (2003). "Arthritis associated with enteric infection". Best Pract Res Clin Rheumatol نسخة محفوظة 10 يونيو 2018 على موقع واي باك مشين.
- ^ Hansen P, Wenzel B, Brix T, Hegedüs L (2006). "Yersinia enterocolitica infection does not confer an increased risk of thyroid antibodies: evidence from a Danish twin study". Clin Exp Immunol. 146 (1): 32–8
- ^ Tomer Y, Davies T (1993). "Infection, thyroid disease, and autoimmunity" نسخة محفوظة 23 سبتمبر 2009 على موقع واي باك مشين. (PDF). Endocr Rev. 14 (1): 107–20. معرف الوثيقة الرقمي:10.1210/er.14.1.107. ببمد 8491150. نسخة محفوظة 26 يناير 2018 على موقع واي باك مشين.
- ^ Strieder T, Wenzel B, Prummel M, Tijssen J, Wiersinga W (2003). "Increased prevalence of antibodies to enteropathogenic Yersinia enterocolitica virulence proteins in relatives of patients with autoimmune thyroid disease". Clin Exp Immunol. نسخة محفوظة 16 مارس 2020 على موقع واي باك مشين.
وصلات خارجية
عدل- علم الأحياء الدقيقة
- أوصاف المُمرِضَات الشائعة
- Yersinia enterocolitica genomes and related information at PATRIC, a Bioinformatics Resource Center funded by المعهد الوطني للحساسية والأمراض المعدية
| يرسينيا القولون في المشاريع الشقيقة: | |
| |