فلوريد الزرنيخ الخماسي
فلوريد الزرنيخ الخماسي (أو خماسي فلوريد الزرنيخ) هو مركب كيميائي صيغته AsF5، ويوجد في الشروط القياسية على شكل غاز عديم اللون.
| فلوريد الزرنيخ الخماسي | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Arsenic pentafluoride |
|
| أسماء أخرى | |
Arsenic(V) fluoride, |
|
| المعرفات | |
| CAS | 7784-36-3 |
| بوب كيم | 82223 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | AsF5 |
| الكتلة المولية | 169.91 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 2.14 غ/سم3 (مقيسة بالطور السائل عند نقطة الغليان) |
| نقطة الانصهار | −79.8 °س |
| نقطة الغليان | −52.8 °س |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H280, H319, H350, H361, H370, H372 |
| بيانات وقائية وفق GHS | P201, P202, P260, P264, P270, P280, P281, P305+351+338, P307+311, P308+313, P314, P321, P337+313, P405 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ينتمي المركب إلى مجموعة الفلوريدات، وهو سام مثل باقي مركبات الزرنيخ اللاعضوية.
التحضير عدل
يحضر المركب من التفاعل المباشر للعنصرين المكونين له الزرنيخ والفلور:[3] [4]
كما يمكن أن تتم عملية التحضير من الفلورة اللاحقة لمركب فلوريد الزرنيخ الثلاثي:
الخواص عدل
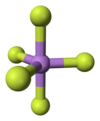
يوجد المركب في الشروط القياسية على شكل غاز عديم اللون، وله بنية جزيئية هرمية ثلاثية مضاعفة. يبلغ طول الرابطة As−F المحورية في الحالة الصلبة مقدار 171.9 بيكومتر، أما الاستوائية فمقدارها 166.8 بيكومتر.[4]
يشكل خماسي فلوريد الزرنيخ معقدات هاليدية، ويتميز بكونه مستقبل جيد للإلكترونات كما يتضح في التفاعل مع رباعي فلوريد الكبريت:
- .
كما يشكل معقدات مختلفة مع ثنائي فلوريد الزينون:[5]
المخاطر عدل
إن مركب فلوريد الزرنيخ الثلاثي سام جداً مثل باقي مركبات الزرنيخ اللاعضوية.
مراجع عدل
- ^ أ ب ت Arsenic pentafluoride (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 198–9.
- ^ أ ب Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ Ralf Steudel: Chemie der Nichtmetalle, Synthesen – Strukturen – Bindung – Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 570, (Walter De Gruyter Online).
| فلوريد الزرنيخ الخماسي في المشاريع الشقيقة: | |
| |