هيموغلوبين
هيموغلوبين[1] أو هيموجلوبين أو خضاب الدم أو اليحمور[2] (بالإنجليزية: Haemoglobin) هو بروتين محمول داخل خلايا الدم الحمراء ويحتوي على ذرات الحديد (Fe). يلتقط الأوكسجين في الرئتين ويسلّمه إلى الأنسجة للحفاظ على حياة الجسم. يتكون الهيموجلوبين من بروتينين متماثلين ملتصقين ببعضهما بعضا. يجب تواجد كِلا البروتينين ليستطيع الهيموجلوبين تحميل وإعطاء الأوكسجين لخلايا الجسم. أحد البروتينين يدعى ألفا، والآخر بيتا. قبل الولادة، لا يتم إنتاج بروتين بيتا. لكن يوجد بروتين آخر يحل مكانه يسمى غاما، وهو لا يوجد إلا في طور الجنين، ويعمل كبديل للبيتا حتى وقت الولادة.
hemoglobin (heterotetramer, (αβ)2)
| ||
| ||
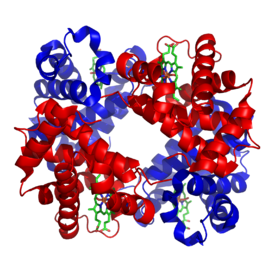
| بنية الهيموغلوبين البشري. الوحدات الفرعية α و βللبروتينات ملونة بالأحمر والأزرق، أما مجموعات الهيم المحتوية على الحديد فملونة باللون الأخضر. مأخوذة من ببب: 1GZX بروتيوبيديا Hemoglobin | ||
| − | ||
| نوع البروتين | بروتين معدني، غلوبيولين | |
| الوظيفة | نقل الأوكسجين | |
| العامل/ العوامل المرافقة | هيم (4) | |
| − | ||
| اسم الوحدة الفرعية |
الجين | الموقع الكروموسومي |
| Hb-α1 | HBA1 | صبغي 16 (إنسان) p13.3 |
| Hb-α2 | HBA2 | صبغي 16 (إنسان) p13.3 |
| Hb-β | HBB | صبغي 11 (إنسان) p15.5 |
مثل جميع البروتينات، مخطّطات تصنيع الهيموجلوبين مخزنة داخل الـ الحمض النووي الريبوزي منقوص الأكسجين (المادة التي تكون الجينات). الإنسان لديه، في العادة، أربعة جينات للتحكم بتصنيع بروتين ألفا (سلسلة ألفا). بينما يتحكم جينان آخران في تصنيع سلسلة البيتا. (يوجد أيضا جينين إضافيين للتحكم بإنتاج سلسلة غاما لدى الجنين). يتم إنتاج سلسلة ألفا وبيتا بنفس الكمية، على الرغم من العدد المختلف للجينات. ترتبط سلاسل البروتين تلك بخلايا الدم الحمراء النامية، وتبقى معا طيلة حياة خلية الدم الحمراء.
التشخيص عدل
يعد قياس تركيز الهيموغلوبين من بين اختبارات الدم الأكثر شيوعا، عادة كجزء من تعداد الدم الكامل. على سبيل المثال، عادة ما يتم اختباره قبل أو بعد التبرع بالدم. يتم الإبلاغ عن النتائج في جم/لتر، جم/ديسيلتر، أو مول/لتر. 1 جم/ديسيلتر يساوي حوالي 0.6206 مليمول/لتر، على الرغم من أن الوحدات الأخيرة لا تستخدم في كثير من الأحيان بسبب عدم اليقين بشأن الحالة البوليمرية للجزيء.
| معدل توزيع الهيموغلوبين الطبيعي | |
|---|---|
| الجنس | النسبة الطبيعية |
| الرجال | 13.5–17.5 |
| النساء، غير الحوامل | 12.0–16.0 |
| النساء، الحوامل | 11.0–14.0 |
| الأطفال | 10.5–16.0 |
يجب أن تكون القيم الطبيعية للهيموغلوبين في الثلثين الأول والثالث من الحمل من النساء الحوامل 11 جم/ديسيلتر على الأقل و 10.5 جم/ديسيلتر على الأقل خلال الثلث الثاني من الحمل.[3]
يمكن أن يؤثر الجفاف أو فرط الترطيب بشكل كبير على مستويات الهيموغلوبين المقاسة. يمكن أن يشير الألبومين إلى حالة الترطيب.
إذا كان التركيز أقل من المعدل الطبيعي، فهذا ما يسمى فقر الدم. يصنف فقر الدم حسب حجم خلايا الدم الحمراء، وهي الخلايا التي تحتوي على الهيموغلوبين في الفقاريات. يسمى فقر الدم «صغير الكريات» إذا كانت الخلايا الحمراء صغيرة، و«كبير الكريات» إذا كانت كبيرة، و«طبيعي الكريات» خلاف ذلك.
يمكن أن يحدث نقص الهيموغلوبين إما بسبب انخفاض كمية جزيئات الهيموغلوبين، كما هو الحال في فقر الدم، أو بسبب انخفاض قدرة كل جزيء على ربط الأكسجين بنفس الضغط الجزئي للأكسجين. اعتلالات الهيموغلوبين (عيوب وراثية تؤدي إلى بنية غير طبيعية لجزيء الهيموغلوبين)[4] قد تسبب كليهما. على أي حال، يقلل نقص الهيموغلوبين من قدرة الدم على حمل الأكسجين. يتميز نقص الهيموغلوبين، بشكل عام، بشكل صارم عن نقص التأكسج، على الرغم من أن كلاهما سببان لنقص الأكسجة (عدم كفاية إمدادات الأكسجين إلى الأنسجة). تشمل الأسباب الشائعة الأخرى لانخفاض الهيموغلوبين فقدان الدم، نقص الحديد، نقص فيتامين بي12، نقص المغذيات، مشاكل نخاع العظام، العلاج الكيميائي، الفشل الكلوي أو الهيموغلوبين غير الطبيعي (مثل مرض الخلايا المنجلية، والثلاسيميا).
يؤدي انخفاض الهيموغلوبين، مع أو بدون انخفاض مطلق في خلايا الدم الحمراء، إلى أعراض فقر الدم. فقر الدم له العديد من الأسباب المختلفة، على الرغم من أن نقص الحديد وفقر الدم الناجم عنه بسبب عوز الحديد هما السببان الأكثر شيوعا في العالم الغربي. تعتبر أنواع فقر الدم الأخرى اقل شيوعا.
الهيماتوكريت، نسبة حجم الدم التي تشغلها خلايا الدم الحمراء، عادة ما تكون حوالي ثلاثة أضعاف تركيز الهيموغلوبين المقاس بالجرام/ديسيلتر. على سبيل المثال، إذا تم قياس الهيموغلوبين عند 17 جم / ديسيلتر، فإن ذلك يقارن مع الهيماتوكريت بنسبة 51٪.[5]
يمكن قياس التحكم طويل الأجل في تركيز السكر في الدم بتركيز Hb A1c (هيموغلوبين سكري). يتطلب قياسه مباشرة العديد من العينات لأن مستويات السكر في الدم تختلف اختلافا كبيرا خلال اليوم. Hb A1c هو نتاج التفاعل الذي لا رجعة فيه للهيموغلوبين A مع الجلوكوز. يؤدي ارتفاع تركيز الجلوكوز إلى المزيد من Hb A1c. نظرا لأن التفاعل بطيء، فإن نسبة Hb A1c تمثل مستوى الجلوكوز في الدم المتوسط على مدى عمر النصف لخلايا الدم الحمراء، وعادة ما يكون ~ 120 يوما. تظهر نسبة Hb A1c البالغة 6.0٪ أو أقل تحكما جيدا في الجلوكوز على المدى الطويل، في حين أن القيم التي تزيد عن 7.0٪ مرتفعة. هذا الاختبار مفيد بشكل خاص لمرضى السكري.
ترتبط المستويات المرتفعة من الهيموغلوبين بزيادة أعداد أو أحجام خلايا الدم الحمراء، وتسمى كثرة الحمر. قد يكون سبب هذا الارتفاع هو أمراض القلب الخلقية، مرض القلب الرئوي، التليف الرئوي، الكثير من الإريثروبويتين، أو كثرة الحمر الحقيقية.[6] قد تحدث مستويات عالية من الهيموغلوبين أيضا بسبب التعرض لارتفاعات عالية، التدخين، الجفاف (ارتفاع مصطنع)، أمراض الرئة المتقدمة، وبعض الأورام.[7]
خلايا الدم الحمراء عدل
خلايا الدم الحمراء تتكوّن من جزئين. اليحمور في داخل الخلية على شكل سائل. وغشاء يحيط به مشكلا شكل الخلية الخارجي ويحوي اليحمور في الداخل. يمكن تمثيل الخلية ببالون ماء مطاطي. المطاط سيكون غشاء الخلية، والماء هو اليحمور. فصائل الدم المعروفة وهي، أي، بي، أو، وأي بي، هي خصائص الغشاء. بينما يكون اليحمور داخل الخلايا الحمراء متماثلا بين جميع أنواع الفصائل وعند جميع البشر. ويمكن تشبيه ذلك بأنفوخات (بالونات) الماء الملونة، فهنالك الأنفوخات ذات المطاط الأحمر وهنالك الأنفوخات ذات المطاط الأصفر وهكذا، وجميعها تحوي الماء.
إنتاج الهيموغلوبين عدل
يتطلّب إنتاج خضاب الدم أو الهيموجلوبين تنسيق إنتاج الهيم والجلوبين. الهيم Heme هي مَجْمُوْعَةٌ ضَميمَة prosthetic group تقوم بالمساعدة بالربط القابل للعكس للأوكسجين مع اليحمور. بينما الغلوبين Globin هو البروتين الذي يحيط ويحمي جزيئة الهيم. تتشكل أربعة سلاسل من الغلوبين (سلسلتا ألفا وسلسلتا بيتا) بصورة تشبه الديدان الملتفة. كل سلسلة من الجلوبين تحتوي مجموعة هيمي صغيرة. في مركز كل مجموعة هيمي توجد أيون ذرة الحديد (Fe). في الشكل الأول في الأعلى يظهر الجلوبين المكون من كل من سلسلتي البيتا باللون البرتقالي وسلسلتي الألفا الحمراء، بينما تظهر جزيئات الهيم باللون الأزرق.
تأثير بور عدل
قدرة اليحمور على إطلاق الأوكسجين تتأثّر بقيمة مؤشر الحموضة وبتركيز ثاني أكسيد الكربون CO2 ، وكذلك بالاختلافات في بيئة الرئتين الغنية بالأوكسجين وبيئة الأنسجة قليلة الأوكسجين. تكون قيمة مؤشر الحموضة في الأنسجة أقل إلى حد كبير (أكثر حامضية) من قيمتة الباهاء في الرئتين. يتم توليد البروتونات خلال التفاعل بين ثاني أكسيد الكربون والماء لتشكيل ثنائي الكربونات.
CO2 + H2O → H2CO3 → HCO3- + H+
هذه الحموضة المتزايدة تخدم غرضين. أولا، تضعف البروتونات الرابط بين اليحمور والأوكسجينِ، مما يسمح بإطلاق الأكسجين بصورة سهلة إلى الأنسجة. عند إطلاق ذرات الأكسجين الأربعة المرتبطة باليحمور، يرتبط اليحمور مع بروتونين. هذا يؤدي لدفع توازن التفاعل نحو الجانب الأيمن من المعادلة. هذا هو ما يعرف بتأثير بور، وهو حيوي في إزالة ثاني أكسيد الكربون لأن ثاني أكسيد الكربون لا يذوب في مجرى الدم. إنّ أيونات ثنائي الكربونات لها قابلية للذوبان أعلى بكثير، وعليه، يمكن إعادتها إلى الرئتين بعد ارتباطها باليحمور. إذا لم يستطع اليحمور امتصاص البروتونات الزائدة، سينتقل توازن التفاعل إلى يسار المعادلة، ولن يصبح في الإمكان التخلص من ثاني أكسيد الكربون.
في الرئتين، يعمل هذا التأثير بإتجاه عكسي. عند وجود تركيز عالي للأكسجين في الرئتين، فإن ارتباط البروتون يضعف. ويتم إطلاق البروتونات، مما يؤدي إلى نقل توازن التفاعل إلى اليسار، مما يشكل ثاني أكسيد الكربون عديم الذوبان والّذي يطرد عن طريق الرئتين. اليحمور قليل البروتونات له ميل أكبر للإتحاد مع الأكسجين، وهكذا تستمر دورة نقل الأوكسجين والتخلص من ثاني أكسيد الكربون مع الزفير .
المشاكل الوراثية عدل
كون تركيب اليحمور هو نفسه لدى جميع البشر، هو أمر ناتج عن كون الجينات التي تشفّر اليحمور متماثلة أيضا لدى جميع البشر. من حين لآخر، يتغير أحد الجينات لسبب أو لآخر من الأسباب التي يمكن أن تحدث في الطبيعة. هذه الطفرات في الجينات نادرة جداً. وبما أن الجينات يتم توريثها، فهذا يعني أن الجين الذي ينتج يحمورا شاذاً لدى فرد معين، سينتقل إلى أطفاله. والأطفال سينتجون اليحمور الطافر والمماثل لذلك عند الوالد. معظم الطفرات التي تصيب جينات إنتاج اليحمور لا تسبب أي مشكلة. لكن طبعا أي تغير في البروتين سيغر سماته وسلوكه. أنواع الاضطرابات التي يمكن أن تنتج تتضمّن مرض الخلية المنجلية والتلاسيميا.
على الرغم من أن التغييراتِ التي تنتج اليحمور الشاذ نادرة، إلا أنه يوجد المئات من اليحمور الشاذ (أو «اليحمور المغاير»). هذا التغاير نتج خلال ملايين السنوات من التطور البشري. معظم اليحمور المغاير يعمل ويقوم بمهامه بصورة جيدة، ولا يمكن معرفة الإصابة به إلا من خلال فحص دنا حيث أنه لا أعراض جانبية له. بعض أنواع اليحمور الشاذ، لا يؤدي وظيفته بصورة اعتيادية ويمكن أن ينتج اضطرابات سريرية، مثل مرض الخلية المنجلية.
الجينات يمكن أن تصاب بضرر يؤدي إلى عدم قدرتها على إنتاج كميات طبيعية من اليحمور. في العادة، أحد مجموعات جينات اليحمور تتأثّرة، إما مجموعة جين ألفا أو مجموعة جين بيتا. على سبيل المثال، أحد جيني بيتا قد يخفق في إنتاج كمية طبيعية من بروتين سلسلة بيتا. وستكون جينات ألفا الأربعة تعمل على إنتاج كمية طبيعية من بروتين سلسلة ألفا. سيظهر عدم توازن في كمية بروتين سلسلة ألفا وبروتين سلسلة البيتا داخل الخلية. حيث سيكون هناك كمية من سلسلة ألفا أكثر من اللازم. عدم التوازن هذا يدعى التلاسيميا. في هذا المثال السابق، هو ستكون الحالة هي تلاسيميا بيتا، وذلك لكون جين سلسلة البيتا هو الذي أخفق.
تطور الهيموغلوبين في الفقاريات عدل
يتفق العلماء على أن الحدث الفاصل بين الميوغلوبين والهيموغلوبين وقع بعد انفصال الجلكيات عن الفقاريات ذات الفك. سمح هذا الانفصال بظهور وظائف مختلفة لهذين الجزيئين وتطورها، إذ تتمحور وظيفة الهيموغلوبين حول تخزين الأكسجين، بينما يعنى الميوغلوبين بنقله.[8]
تشفر جينات الغلوبين الشبيهة بألفا وبيتا الوحدات الفرعية المفردة للبروتين. نشأت أسلاف هذه الجينات خلال حدث تنسخ آخر بعد ظهور السلف المشترك للفكيات من الأسماك عديمة الفك منذ 450-500 مليون عام. تقترح دراسات ترميم السلف أن سلف جيني ألفا وبيتا السابق للانتساخ كان ثنائي قسيمات مصنوعًا من وحدات فرعية غلوبينية متطابقة تطورت لاحقًا لتجتمع في بنية رباعية القسيمات بعد الانتساخ. مكن تطور جيني ألفا وبيتا من اصطناع الهيموغلوبين من وحدات فرعية منفصلة متعددة، وهذا التركيب الفيزيائي أساسي لقدرة الهيموغلوبين على نقل الأوكسجين. يساهم امتلاك عدة وحدات فرعية في قدرة الهيموغلوبين على ربط الأكسجين تشاركيًا إضافةً إلى تنظيم الجزيء التفارغي.[9]
خضع جين ألفا تاليًا لحدث انتساخ ليشكل الهيموغلوبين إيه 1 وإيه 2. شكلت هذه الانتساخات والاختلافات الإضافية مجموعةً متنوعةً من جينات الغلوبين الشبيهة بألفا وبيتا والتي تنتظم لتكوين بعض الأشكال في مراحل مختلفة من التطور. خسرت أغلب أسماك الجليد من عائلة الماكريل الجليدي جينات الهيموغلوبين التي تحملها خلاياها لتتكيف مع برودة المياه.[10]
حالة أكسدة الحديد في الهيموغلوبين المؤكسج عدل
من الصعب تحديد حالة أكسجة الهيموغلوبين لأن الهيموغلوبين المؤكسج Hb-O2 معكوس المغناطيسية وفقًا للطرق التجريبية (لا يملك إلكترونات مفردةً صرفةً)، بينما تكون التوزيعات الإلكترونية الأقل طاقة (في الحالة الدنيا) ذات مغناطيسية مسايرة (ما يقترح وجود إلكترون واحد غير مقترن على الأقل في المعقد الجزيئي). تشمل الأشكال ذات الطاقة الأدنى من الأكسجين والحديد المؤكسد المرتبط به ما يلي:
- الأكسجين الثلاثي: النوع الجزيئي الأقل طاقة من الأكسجين، ويحمل إلكترونين مفردين على المدارات الجزيئية باي* المضادة للترابط.
- يميل الحديد ذو التكافؤ الثنائي إلى التواجد ضمن توزع 3d6 عالي عزم اللف المغزلي مع أربعة إلكترونات مفردة.
- يملك الحديد ذو التكافؤ الثلاثي (3d5) عددًا مفردًا من الإلكترونات، وبالتالي يحمل إلكترونًا واحدًا مفردًا على الأقل بصرف النظر عن حالة الطاقة الخاصة به.
تملك جميع هذه البنى حقلًا مغناطيسيًا مسايرًا (تحمل إلكترونات مفردة)، وبالتالي يفترض وجود توزع غير حدسي للإلكترونات (الطاقة الأعلى لنوع واحد على الأقل) باجتماع الحديد والأكسجين لتفسير المغنطة المعاكسة الملحوظة مع غياب الإلكترونات غير المقترنة.
يشمل الاحتمالان المنطقيان الموافقان لإنتاج حقل مغناطيسي عكسي (دون عزم دوران صاف) للهيموغلوبين المؤكسج ما يلي:
- ارتباط الحديد ثنائي التكافؤ Fe+2 منخفض عزم اللف المغزلي بالأكسجين المنفرد، ويكون كل منهما معكوسي المغنطة، لكن الصيغ المنفردة من الأكسجين تمثل الشكل الأعلى طاقةً في الجزيء.
- ارتباط الحديد ثلاثي التكافؤ Fe+3 منخفض عزم اللف المغزلي بأيون فوق الأكسيد O2- والزوجين الإلكترونيين غير المقترنين المضادين للانجذاب المغناطيسي، وهذا يمنحه خصائص مغناطيسية معاكسة ملحوظة. هنا يخضع الحديد لتفاعل أكسدة (يخسر إلكترونًا واحدًا) والأكسجين لتفاعل إرجاع (يكسب إلكترونًا واحدًا).
في أحد النماذج المحتملة الأخرى، يرتبط الحديد رباعي التكافؤ Fe+4 منخفض عزم اللف المغزلي بالبيروكسيد O2−2 والذي يمكن أن يترك موقعه بنفسه لأن الحديد يملك مجالًا مغناطيسيًا مسايرًا (يوافق مجال البيروكسيد)، وهنا يؤكسد الحديد بخسارة إلكترونين، بينما يُرجع الأكسجين باكتساب إلكترونين.
انظر أيضًا عدل
مراجع عدل
- ^ المعجم الطبي الموحد.
- ^ المعجم الموحد لمصطلحات علم الأحياء، سلسلة المعاجم الموحدة (8) (بالعربية والإنجليزية والفرنسية)، تونس: مكتب تنسيق التعريب، 1993، ص. 178، OCLC:929544775، QID:Q114972534
- ^ Sharon Smith (2006). Foundations of maternal-newborn nursing (ط. 4th ed). St. Louis, Mo.: Elsevier Saunders. ISBN:978-1-4160-0141-6. OCLC:60825596. مؤرشف من الأصل في 2022-11-25.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) - ^ "Dorlands Medical Dictionary:hemoglobinopathy". web.archive.org. 16 يونيو 2009. مؤرشف من الأصل في 2009-06-16. اطلع عليه بتاريخ 2022-09-26.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ "Hematocrit (HCT) or Packed Cell Volume (PCV)- Doctors Lounge(TM)". www.doctorslounge.com. مؤرشف من الأصل في 2022-03-04. اطلع عليه بتاريخ 2022-09-26.
- ^ "Hemoglobin: MedlinePlus Medical Encyclopedia". medlineplus.gov (بالإنجليزية). Archived from the original on 2022-04-02. Retrieved 2022-09-26.
- ^ "Hemoglobin: Normal, High, Low Levels, Age, Chart, Treatment & Symptoms". MedicineNet (بالإنجليزية). Archived from the original on 2022-09-22. Retrieved 2022-09-26.
- ^ Hardison، Ross C. (1 ديسمبر 2012). "Evolution of hemoglobin and its genes". Cold Spring Harbor Perspectives in Medicine. ج. 2 ع. 12: a011627. DOI:10.1101/cshperspect.a011627. ISSN:2157-1422. PMC:3543078. PMID:23209182.
- ^ Pillai, Arvind S.; Chandler, Shane A.; Liu, Yang; Signore, Anthony V.; Cortez-Romero, Carlos R.; Benesch, Justin L. P.; Laganowsky, Arthur; Storz, Jay F.; Hochberg, Georg K. A.; Thornton, Joseph W. (May 2020). "Origin of complexity in haemoglobin evolution". Nature (بالإنجليزية). 581 (7809): 480–85. Bibcode:2020Natur.581..480P. DOI:10.1038/s41586-020-2292-y. ISSN:1476-4687. PMC:8259614. PMID:32461643. S2CID:218761566.
- ^ Sidell، Bruce؛ Kristin O'Brien (2006). "When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes". The Journal of Experimental Biology. ج. 209 ع. Pt 10: 1791–802. DOI:10.1242/jeb.02091. PMID:16651546.
روابط خارجية عدل
| هيموغلوبين في المشاريع الشقيقة: | |
| |