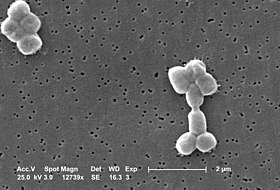
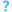راكدة بومانية
راكدة بومانية | |
|---|---|
| المرتبة التصنيفية | نوع |
| التصنيف العلمي | |
| النطاق: | الجراثيم |
| المملكة: | بكتيريا |
| الشعبة: | المتقلبات |
| الطائفة: | متقلبات غاما |
| الرتبة: | الزوافات |
| الفصيلة: | الموراكسيلية |
| الجنس: | الراكدة |
| النوع: | راكدة بومانية |
| الاسم العلمي | |
| Acinetobacter baumannii [1] Bouvet & Grimont، 1986 |
|
| تعديل مصدري - تعديل | |
راكدة بومانية (الاسم العلمي: Acinetobacter baumannii) هي نوع من البكتيريا يتبع جنس الراكدة من الفصيلة الموراكسيلية.[2][3] وهي بكتيريا لا هوائية سلبية الغرام على شكل قضيب مستدير تقريبا، ويمكن أن تكون مُمْرِضًا انتهازيًا للبشر، مما يؤثر على الأشخاص الذين يعانون من ضعف المناعة، كما أنها مقاومة للعديد من المضادات الحيوية ولذا فهي من الإصابات البكتيرية القاتلة وخصوصا في إصابات المشافي. وفي حين أن الأنواع الأخرى من جنس الراكدة غالبا ما توجد في عينات التربة (مما يؤدي إلى الاعتقاد الخاطئ بأن الراكدة البومانية هي كائن ترابي أيضا)، إلا أنها يتم عزلها من بيئات المستشفيات،[4] وعلى الرغم من أنه يتم العثور عليها في بعض الأحيان في عينات التربة والماء البيئية[5] إلا أن موطنها الطبيعي لا يزال غير معروف.
وتفتقر البكتيريا الموجودة في هذا النوع من السلالة إلى تركيب يشبه السوط تستخدمها العديد من البكتيريا في الحركة، ولكنها تُظهر اضطرابًا أو حركة متدفقة. وقد يكون ذلك بسبب نشاط النوع الرابع من الأشعار البكتيرية، وهي هياكل شبيهة بالقطب يمكن تمديدها وسحبها. وقد تكون الحركة في الراكدة البومانية أيضا بسبب إفراز عديد السكاريد الخارجي، وخلق غشاء حيوي رقيق لسلاسل السكر ذات الوزن الجزيئي العالي وراء البكتيريا للمضي قدما.[6] وعادة ما يميز علماء الأحياء المجهرية السريرية أعضاء جنس الراكدة من الموراكسيليات الأخرى عن طريق إجراء اختبار الأوكسيداز، حيث أن البكتيريا الراكدة هي الأعضاء الوحيدة في الموراكسيليات، التي تفتقر إلى وجود سيتوكروم سي أكسيداز.[7]
والراكدة البومانية هي جزء من مجمع ACB (الراكدة البومانية، وراكدة خلات الكالسيوم، والأنواع الجينية 13TU للراكدة). ومن الصعب تحديد أعضاء مجموعة ACB، التي تضم أكثر أعضاء ذلك الجنس المتعلقة بالعدوى السريرية.[8][9] وقد تم تحديد الراكدة البومانية أيضا كممرض من البكتيريا الستة المعروفة بمقاومتها للمضادات الحيوية (ESKAPE)، وهم (المعوية البرازية، والمكورات العنقودية الذهبية، والكلبسيلة الرئوية، والراكدة البومانية، والزائفة الزنجارية، والأمعائية)، والتي تكون مسؤولة عن غالبية عدوى المستشفيات.[10]
وبالعامية، يُشار إلى الراكدة البومانية باسم بكتيريا العراق "Iraqibacter"؛ بسبب ظهورها المفاجئ على ما يبدو في مرافق المعالجة العسكرية خلال حرب العراق،[11] وظلت مشكلة بالنسبة للمحاربين القدماء والجنود الذين خدموا في العراق وأفغانستان. وقد انتشرت مجموعة الراكدة البومانية المقاومة للأدوية المتعددة إلى المستشفيات المدنية جزئيا بسبب نقل الجنود المصابين خلال مرافق طبية متعددة.[6]
بروتين الغشاء الخارجي أ عدل
يمكن أن يكون الالتصاق من العوامل الحاسمة في تحديد حدة البكتيريا، حيث تسمح القدرة على الارتباط بالخلايا المضيفة للبكتيريا بالتفاعل معها بطرق مختلفة، سواء عن طريق النظام الإفرازي الثالث في البكتيريا أو ببساطة من خلال التمسك بحركة السوائل السائدة. وقد ثبت أن بروتين الغشاء الخارجي (أ) يشارك في التصاق الراكدة البومانية إلى الخلايا الظهارية، مما يسمح للبكتيريا بغزو الخلايا من خلال آلية السوستة،[12] كما وُجِد أن البروتين يتوطن في ميتوكوندريا الخلايا الظهارية، ويسبب نخرها عن طريق تحفيز إنتاج أنواع الأكسجين التفاعلية.[13]
مقاومة المضادات الحيوية عدل
جزر المقاومة AbaR عدل
تتكون الجزر المرضية في البكتيريا، وهي هياكل وراثية شائعة نسبيا في مسببات الأمراض البكتيرية، من اثنين أو أكثر من الجينات المتجاورة التي تزيد من حدة الممرض. وقد تحتوي على جينات تشفر السموم أو تخثر الدم أو كما في تلك الحالة، تسمح للبكتيريا بمقاومة المضادات الحيوية. جزر المقاومة من نوع AbaR هي جزر نموذجية لمقاومة مضادات الراكدة البومانية مع اختلافات قد توجد في سلالة معينة. ويتكون كل منها من العمود الفقري للجينات القابلة للنقل التي تكون حوالي 16.3 كيلو بايت، مما يسهل نقل الجينات الأفقي. وتسمح الجينات القافزة بأخذ أجزاء من المواد الجينية من موضع ما في الجينوم ودمجها في موضع آخر، مما يجعل الانتقال الجيني الأفقي لهذه الجزر المسببة للأمراض المشابهة أكثر احتمالاً؛ لأنه عندما يتم أخذ مادة جينية بواسطة بكتيرة جديدة، تسمح الجينات القافزة للجزيرة الإمراضية بالاندماج في جينوم الكائنات الحية الدقيقة الجديدة. وفي هذه الحالة، يُمنَح الكائن الدقيق الجديد القدرة على مقاومة بعض المضادات الحيوية. وتحتوي AbaRs على العديد من الجينات لمقاومة المضادات الحيوية، وكلها محاطة بتتابعات الإدراج. وتوفر هذه الجينات مقاومة ضد الأمينوغليكوزيدات، وأمينوكليكليتول، والتتراسيكلين، والكلورامفينيكول.[14][15]
مضخات الإخراج عدل
مضخات الإخراج هي عبارة عن آلات بروتينية تستخدم الطاقة لضخ المضادات الحيوية والجزيئات الصغيرة الأخرى التي تدخل في السيتوبلازم البكتيري والفضاء المحيطي خارج الخلية. ومن خلال ضخ المضادات الحيوية باستمرار خارج الخلية، يمكن للبكتيريا أن تزيد من تركيز المضاد الحيوي اللازم لقتلها أو تثبيط نموها عندما يكون الهدف من المضاد الحيوي العمل داخل البكتيريا. ومن المعروف أن الراكدة البومانية تمتلك مضختين ضخمتين رئيسيتين، مما يقلل من قابليتها لمضادات الميكروبات. وقد تبين أن أول جزيرة وهي AdeB هي المسؤولة عن مقاومة الأمينوغليكوزيد،[16] وثاني جزيرة AdeDE هي المسؤولة عن إخراج مجموعة واسعة من الركائز، بما في ذلك التتراسيكلين والكلورامفينيكول والكاربابينيمات المختلفة.[17]
الحمض النووي الريبي الصغير عدل
الحمض النووي الريبوزي الميكروبي الصغير هو عبارة عن حمض نووي ريبوزي غير مشفر يقوم بتنظيم العمليات الخلوية المختلفة. وتم التحقق من صحة ثلاثة أنواع منه هي AbsR11 وAbsR25 وAbsR28 في سلالة MTCC 1425 (ATCC15308)، وهي سلالة (مقاومة للأدوية المتعددة) تُظهِر مقاومة لـ12 مضاد حيوي. ويمكن أن يلعب الحمض النووي الريبوزي من نوع AbsR25 دورًا في تنظيم المضخة الإخراجية ومقاومة الأدوية.[18]
بيتا لاكتاماز عدل
لقد تم إثبات أن الراكدة البومانية تنتج على الأقل إنزيم بيتا لاكتاماز واحد، وهو إنزيم مسؤول عن شق حلقة اللاكتام ذات الأربع ذرات والمميزة للمضادات الحيوية المتعلقة بالبيتا لاكتام. وترتبط مضادات البيتا لاكتام هيكليا بالبنسلين، الذي يمنع تصنيع جدار الخلية البكتيرية. وشق حلقة اللاكتام يجعل هذه المضادات الحيوية غير ضارة للبكتيريا، وتم العثور على بيتا لاكتاماز OXA-23 محاطًا بمتتابعات الإدراج، مما يشير إلى أنه تم اكتسابها عن طريق نقل الجينات الأفقي.[19]
تشكيل البيوفيلم عدل
قد لوحظت القدرة الظاهرية للراكدة البومانية على البقاء على الأسطح الاصطناعية لفترة طويلة من الزمن، مما يسمح لها بالعيش في بيئة المستشفى. ويعتقد أن ذلك يرجع إلى قدرتها على تشكيل الأغشية الحيوية (البيوفيلم).[20] وبالنسبة للعديد من البكتيريا المكونة للبيوفيلم، يتم توسط العملية بواسطة أسواط. وبالنسبة للراكدة البومانية، يبدو أن هذه العملية تتوسطها شعيرات. وقد تبين أن تعطيل الجينات المفترضة وجينات csuC وcsuE يثبط تشكيل الأغشية الحيوية،[21] كما تبين أن تشكيل الأغشية الحيوية يغير التمثيل الغذائي للكائنات الحية الدقيقة داخل البيوفيلم، وبالتالي تقليل حساسيتهم للمضادات الحيوية. وقد يكون ذلك بسبب وجود عدد أقل من العناصر المغذية داخل الغشاء الحيوي. ويمكن لعملية الأيض البطيئة أن تمنع البكتيريا من تناول مضاد حيوي أو أداء وظيفة حيوية بسرعة كافية لمضادات حيوية معينة ليكون لها تأثير. كما أنها توفر حاجزًا فعليًا ضد الجزيئات الكبيرة وقد تمنع جفاف البكتيريا.[5][22]
علامات وأعراض العدوى عدل
الراكدة البومانية هي بكتيريا انتهازية تسبب مجموعة مختلفة الأمراض لكل منها أعراضها الخاصة، وبعض أنواع العدوى المحتملة تشمل:
- التهاب رئوي
- التهابات مجرى الدم
- التهاب السحايا
- التهابات الموقع الجراحي والجرح، بما في ذلك مرض أكل اللحم
- عدوى الجهاز البولي
غالبا لا يمكن تمييز أعراض عدوى الراكدة البومانية عن أنواع العدوى الانتهازية الأخرى التي تسببها بكتيريا انتهازية أخرى، بما في ذلك الكلبسيلة الرئوية والمكورة الرئوية.
ومن أعراض العدوى: الحمى، والقشعريرة، والطفح الجلدي، والارتباك و/أو الحالات العقلية المتغيرة، والألم عند التبول، والحاجة القوية للتبول بشكل متكرر، والحساسية للضوء الساطع، والغثيان (مع أو بدون القيء)، وآلام في العضلات والصدر، ومشاكل في التنفس، وسعال (مع أو بدون مخاط أصفر أو أخضر أو دموي).[23] وفي بعض الحالات، قد لا تظهر أية أعراض أو عدوى كما هو الحال مع استعمار جرح مفتوح أو موقع الرغامي.
العلاج عدل
أصبح تحديد حساسية الدواء الخاص بالعدوى ضروريا لإنجاح العلاج؛ لأن معظم العدوى أصبحت الآن مقاومة للعديد من الأدوية. ويتم عادة علاج العدوى بالإيميبينيم أو ميروبينم، ولكن لوحظ ارتفاع مطرد في مقاومة الراكدة البومانية للكاربابينيم.[24] وبالتالي، فإن طرق العلاج غالبًا ما تعود إلى البوليميكسين، خاصة الكولستين.[25] ويعتبر الكوليستين الملاذ الأخير؛ لأنه غالبا ما يسبب تلف الكلى وغيرها من الآثار الجانبية الأخرى.[26] وتركز طرق الوقاية في المستشفيات على زيادة غسل اليدين وإجراءات التعقيم الأكثر جدية،[27] وتم علاج الراكدة البومانية مؤخرًا باستخدام العاثيات (الفيروسات المضادة للبكتيريا).[28]
حدوث العدوى في قدامى المحاربين المصابين في العراق وأفغانستان عدل
يتعرض الجنود في العراق وأفغانستان لخطر الإصابات الناجمة عن إطلاق النار والعبوات الناسفة. وكان يعتقد في السابق أن العدوى تحدث بسبب التلوث بالراكدة البومانية في وقت الإصابة. وقد أظهرت دراسات لاحقة أنه على الرغم من أن الركدة البومانية قد تكون معزولة بشكل غير معتاد عن البيئة الطبيعية، فمن المرجح أن يتم اكتساب العدوى بشكل جزئي، ويرجع ذلك على الأرجح إلى قدرتها على العيش لفترات طويلة على الأسطح الاصطناعية والعديد من المرافق التي يتعرض الجنود المصابين لها خلال عملية إجلاء المصابين، حيث يتم نقل الجنود المصابين أولاً إلى المرافق من المستوى الأول بهدف استقرار حالاتهم. وبناءً على شدة الإصابة، يمكن نقل الجنود إلى مرفق من المستوى الثاني يتألف من فريق جراحي من أجل المزيد من الاستقرار. واعتمادا على الخدمات اللوجيستية للمحلية، قد يُنَقّل الجنود المصابون بين هذه المرافق عدة مرات قبل نقلهم إلى مستشفى رئيسي داخل منطقة القتال (المستوى الثالث). وبشكل عام بعد 1 - 3 أيام عندما يتم استقرار المرضى، يتم نقلهم عن طريق الجو إلى مرفق إقليمي (المستوى الرابع، حيث يتم أخيرا نقل الجنود المصابين إلى المستشفيات في بلدهم الأصلي لإعادة التأهيل والعلاج الإضافي.[29] ويبدو أن ذلك التعرض المتكرر للعديد من البيئات الطبية المختلفة هو السبب في أن عدوى الراكدة البومانية أصبحت شائعة بشكل متزايد، ومقاومتها للعديد من الأدوية هو عامل رئيسي في تعقيد علاج وإعادة تأهيل الجنود المصابين، مما أدى إلى المزيد من الوفيات.[8][30][31]
معدل الحدوث في المستشفيات عدل
يُشار إلى أن عدوى الراكدة البومانية على أنها عدوى انتهازية، وهي منتشرة بشكل كبير في المستشفيات، ولا تُشكل سوى القليل من المخاطر على الأفراد الأصحاء،[32] ومع ذلك، تشمل العوامل التي تزيد من مخاطر الإصابة:
- وجود ضعف في جهاز المناعة
- أمراض الرئة المزمنة
- داء السكري
- الإقامة المطولة في المستشفى
- المرض الذي يتطلب استخدام جهاز التنفس الصناعي في المستشفى
- وجود جرح مفتوح يعالج في المستشفى
- العلاجات التي تتطلب أجهزة توغلية، مثل القسطرة البولية
ويمكن أن تنتشر الراكدة البومانية من خلال التلامس المباشر مع الأسطح والأجسام وبشرة الأشخاص الملوثين.[23]
ولقد تم توثيق استيراد البكتيريا إلى المستشفيات،[33] حيث يتم إدخالها عادة إلى المستشفى من قِبَل مريض مستعمر. وبسبب قدرتها على البقاء على الأسطح الاصطناعية ومقاومة التجفيف، يمكن أن تبقى وربما تصيب مرضى جدد لبعض الوقت. ويُشتبه في أن نموها يُفضَل في المستشفيات بسبب الاستخدام المستمر للمضادات الحيوية من قبل المرضى في المستشفى.[34] ويمكن أن تنتشر عن طريق الاتصال الشخصي مع المريض أو الاتصال بالأسطح الملوثة،[35] كما يمكنها الدخول من خلال الجروح المفتوحة والقسطرة وأنابيب التنفس.[36] وفي دراسة أجريت على وحدات الرعاية المركزة الأوروبية في عام 2009، وجد أن بكتيريا الراكدة البومانية مسؤولة عن 19.1٪ من حالات الالتهاب الرئوي المرتبط بالتنفس الصناعي.[37]
وأظهرت دراسة إندونيسية عام 2013 أن عدوى حديثي الولادة ببكتيريا الراكدة البومانية ترجع إلى نفس سلالات البكتيريا الموجودة في المستشفى والتي قضوا بها أيامهم الأولى، وتم العثور على هذه السلالات على الأسطح الصلبة وكذلك على أيدي العاملين في المجال الطبي.[64]
انظر أيضًا عدل
وصلات خارجية عدل
مراجع عدل
- ^ "Species ''Acinetobacter baumannii''" (بالإنجليزية). LPSN. Retrieved 2020-03-31.
- ^ موقع تاكسونوميكون (بالإنكليزية) Taxonomicon راكدة بومانية تاريخ الولوج 10 أيار 2014 نسخة محفوظة 30 يونيو 2016 على موقع واي باك مشين.
- ^ قائمة أسماء بدائيات النوى مع جداول التعريف (بالإنكليزية) LPSN راكدة بومانية تاريخ الولوج 10 أيار 2014 نسخة محفوظة 06 يوليو 2017 على موقع واي باك مشين.
- ^ Antunes، LCS؛ Visca, P؛ Towner, KJ (2014). "Acinetobacter baumannii: evolution of a global pathogen". Pathogens and Disease. ج. 71 ع. 3: 292–301. DOI:10.1111/2049-632X.12125. PMID:24376225.
- ^ أ ب Yeom، J؛ Shin, JH؛ Yang, JY؛ Kim, J؛ Hwang, GS (2013). "(1)H NMR-Based Metabolite Profiling of Planktonic and Biofilm Cells in Acinetobacter baumannii 1656-2". PLoS ONE. ج. 8 ع. 3: e57730. Bibcode:2013PLoSO...857730Y. DOI:10.1371/journal.pone.0057730. PMC:3590295. PMID:23483923.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ أ ب McQueary، CN؛ Kirkup, BC؛ Si, Y؛ Barlow, M؛ Actis, LA؛ Craft, DW؛ Zurawski, DV (يونيو 2012). "Extracellular stress and lipopolysaccharide modulate Acinetobacter baumannii surface-associated motility". Journal of Microbiology. ج. 50 ع. 3: 434–43. DOI:10.1007/s12275-012-1555-1. PMID:22752907.
- ^ Garrity، G.، المحرر (2000). "Pts. A & B: The Proteobacteria". Bergey's Manual of Systematic Bacteriology (ط. 2nd ed., rev.). New York: Springer. ج. 2. ص. 454. ISBN:0-387-95040-0.
- ^ أ ب O'Shea، MK (مايو 2012). "Acinetobacter in modern warfare". International Journal of Antimicrobial Agents. ج. 39 ع. 5: 363–75. DOI:10.1016/j.ijantimicag.2012.01.018. PMID:22459899.
- ^ Gerner-Smidt، P (أكتوبر 1992). "Ribotyping of the Acinetobacter calcoaceticus-Acinetobacter baumannii complex". Journal of Clinical Microbiology. ج. 30 ع. 10: 2680–5. PMC:270498. PMID:1383266.
- ^ Rice، LB (15 أبريل 2008). "Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE". The Journal of Infectious Diseases. ج. 197 ع. 8: 1079–81. DOI:10.1086/533452. PMID:18419525.
- ^ Drummond، Katie. "Pentagon to Troop-Killing Superbugs: Resistance Is Futile". Wired.com. Condé Nast. مؤرشف من الأصل في 2013-06-06. اطلع عليه بتاريخ 2013-04-08.
- ^ Choi، CH؛ Lee, JS؛ Lee, YC؛ Park, TI؛ Lee, JC (10 ديسمبر 2008). "Acinetobacter baumannii invades epithelial cells and outer membrane protein A mediates interactions with epithelial cells". BMC Microbiology. ج. 8: 216. DOI:10.1186/1471-2180-8-216. PMC:2615016. PMID:19068136.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Lee، JS؛ Choi, CH؛ Kim, JW؛ Lee, JC (يونيو 2010). "Acinetobacter baumannii outer membrane protein A induces dendritic cell death through mitochondrial targeting". Journal of Microbiology. ج. 48 ع. 3: 387–92. DOI:10.1007/s12275-010-0155-1. PMID:20571958.
- ^ Seputiene، V.؛ Povilonis, J.؛ Suziedeliene, E. (30 يناير 2012). "Novel Variants of AbaR Resistance Islands with a Common Backbone in Acinetobacter baumannii Isolates of European Clone II". Antimicrobial Agents and Chemotherapy. ج. 56 ع. 4: 1969–1973. DOI:10.1128/AAC.05678-11. PMC:3318354. PMID:22290980.
- ^ Post، V؛ White, PA؛ Hall, RM (يونيو 2010). "Evolution of AbaR-type genomic resistance islands in multiply antibiotic-resistant Acinetobacter baumannii". The Journal of Antimicrobial Chemotherapy. ج. 65 ع. 6: 1162–70. DOI:10.1093/jac/dkq095. PMID:20375036.
- ^ Magnet، S؛ Courvalin, P؛ Lambert, T (ديسمبر 2001). "Resistance-nodulation-cell division-type efflux pump involved in aminoglycoside resistance in Acinetobacter baumannii strain BM4454". Antimicrobial Agents and Chemotherapy. ج. 45 ع. 12: 3375–80. DOI:10.1128/aac.45.12.3375-3380.2001. PMC:90840. PMID:11709311.
- ^ Chau، SL؛ Chu, YW؛ Houang, ET (أكتوبر 2004). "Novel resistance-nodulation-cell division efflux system AdeDE in Acinetobacter genomic DNA group 3". Antimicrobial Agents and Chemotherapy. ج. 48 ع. 10: 4054–5. DOI:10.1128/aac.48.10.4054-4055.2004. PMC:521926. PMID:15388479.
- ^ Sharma، Rajnikant؛ Arya، Sankalp؛ Patil، Supriya Deepak؛ Sharma، Atin؛ Jain، Pradeep Kumar؛ Navani، Naveen Kumar؛ Pathania، Ranjana (1 يناير 2014). "Identification of novel regulatory small RNAs in Acinetobacter baumannii". PLoS One. ج. 9 ع. 4: e93833. Bibcode:2014PLoSO...993833S. DOI:10.1371/journal.pone.0093833. ISSN:1932-6203. PMC:3976366. PMID:24705412.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Higgins، PG؛ Pérez-Llarena, FJ؛ Zander, E؛ Fernández, A؛ Bou, G؛ Seifert, H (25 فبراير 2013). "OXA-235, a novel Class D Beta-Lactamase Involved in Resistance to Carbapenems in Acinetobacter baumannii". Antimicrobial Agents and Chemotherapy. ج. 57 ع. 5: 2121–6. DOI:10.1128/AAC.02413-12. PMC:3632948. PMID:23439638.
- ^ Espinal، P؛ Martí, S؛ Vila, J (يناير 2012). "Effect of biofilm formation on the survival of Acinetobacter baumannii on dry surfaces". The Journal of Hospital Infection. ج. 80 ع. 1: 56–60. DOI:10.1016/j.jhin.2011.08.013. PMID:21975219.
- ^ Tomaras، AP؛ Dorsey, CW؛ Edelmann, RE؛ Actis, LA (ديسمبر 2003). "Attachment to and biofilm formation on abiotic surfaces by Acinetobacter baumannii: involvement of a novel chaperone-usher pili assembly system". Microbiology. ج. 149 ع. Pt 12: 3473–84. DOI:10.1099/mic.0.26541-0. PMID:14663080.
- ^ Worthington، RJ؛ Richards, JJ؛ Melander, C (7 أكتوبر 2012). "Small molecule control of bacterial biofilms". Organic & Biomolecular Chemistry. ج. 10 ع. 37: 7457–74. DOI:10.1039/c2ob25835h. PMC:3431441. PMID:22733439.
- ^ أ ب "What Is Acinetobacter Baumannii?". Everyday Health. مؤرشف من الأصل في 2018-11-27. اطلع عليه بتاريخ 2017-04-18.
- ^ Su، CH؛ Wang، JT؛ Hsiung، CA؛ Chien، LJ؛ وآخرون (2012). "Increase of carbapenem-resistant Acinetobacter baumannii infection in acute care hospitals in Taiwan: Association with hospital antimicrobial usage". بلوس ون. ج. 7 ع. 5: e37788. Bibcode:2012PLoSO...737788S. DOI:10.1371/journal.pone.0037788. PMC:3357347. PMID:22629456.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Abbo، A؛ Navon-Venezia، S؛ Hammer-Muntz، O؛ Krichali، T؛ وآخرون (يناير 2005). "Multidrug-resistant Acinetobacter baumannii". الأمراض المعدية الناشئة (مجلة علمية). ج. 11 ع. 1: 22–9. DOI:10.3201/eid1101.040001. PMC:3294361. PMID:15705318.
- ^ Spapen، H؛ Jacobs، R؛ Van Gorp، V؛ Troubleyn، J؛ وآخرون (25 مايو 2011). "Renal and neurological side effects of colistin in critically ill patients". Annals of Intensive Care. ج. 1 ع. 1: 14. DOI:10.1186/2110-5820-1-14. PMC:3224475. PMID:21906345.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Acinetobacter in Healthcare Settings". CDC. مؤرشف من الأصل في 2019-08-19. اطلع عليه بتاريخ 2013-04-08.
- ^ "He was dying. Antibiotics weren't working. Then doctors tried a forgotten treatment". Mother Jones (بالإنجليزية الأمريكية). Archived from the original on 2019-07-31. Retrieved 2018-05-17.
- ^ "Army Medical Logistics" (PDF). FM 4-02.1. United States. مؤرشف من الأصل (PDF) في 2013-03-23. اطلع عليه بتاريخ 2013-04-08.
- ^ Meghoo، CA؛ Dennis, JW؛ Tuman, C؛ Fang, R (مايو 2012). "Diagnosis and management of evacuated casualties with cervical vascular injuries resulting from combat-related explosive blasts". Journal of Vascular Surgery. ج. 55 ع. 5: 1329–36, discussion 1336–7. DOI:10.1016/j.jvs.2011.11.125. PMID:22325667.
- ^ Murray، CK (مارس 2008). "Epidemiology of infections associated with combat-related injuries in Iraq and Afghanistan". The Journal of Trauma. ج. 64 ع. 3 Suppl: S232–8. DOI:10.1097/ta.0b013e318163c3f5. PMID:18316967.
- ^ "Acinetobacter in Healthcare Settings". Centers for Disease Control and Prevention. US Department of Health and Human Services. مؤرشف من الأصل في 2019-08-19. اطلع عليه بتاريخ 2017-04-18.
- ^ Jones، A؛ Morgan, D؛ Walsh, A؛ Turton, J؛ Livermore, D؛ Pitt, T؛ Green, A؛ Gill, M؛ Mortiboy, D (يونيو 2006). "Importation of multidrug-resistant Acinetobacter spp infections with casualties from Iraq". The Lancet Infectious Diseases. ج. 6 ع. 6: 317–8. DOI:10.1016/S1473-3099(06)70471-6. PMID:16728314.
- ^ Dijkshoorn، L؛ Nemec, A؛ Seifert, H (ديسمبر 2007). "An increasing threat in hospitals: multidrug-resistant Acinetobacter baumannii". Nature Reviews Microbiology. ج. 5 ع. 12: 939–51. DOI:10.1038/nrmicro1789. PMID:18007677.
- ^ "Acinetobacter in Healthcare Settings - HAI - CDC". www.cdc.gov. مؤرشف من الأصل في 2019-08-19. اطلع عليه بتاريخ 2018-04-02.
- ^ Multidrug-Resistant Acinetobacter baumannii (MDRAB).” WHO Western Pacific Region, WPRO | WHO Western Pacific Region, 1 Nov. 2010, www.wpro.who.int/mediacentre/factsheets/fs_20101102/en/.
- ^ Koulenti، D؛ Lisboa, T؛ Brun-Buisson, C؛ Krueger, W؛ Macor, A؛ Sole-Violan, J؛ Diaz, E؛ Topeli, A؛ DeWaele, J؛ Carneiro, A؛ Martin-Loeches, I؛ Armaganidis, A؛ Rello, J (أغسطس 2009). EU-VAP/CAP Study, Group. "Spectrum of practice in the diagnosis of nosocomial pneumonia in patients requiring mechanical ventilation in European intensive care units". Critical Care Medicine. ج. 37 ع. 8: 2360–8. DOI:10.1097/ccm.0b013e3181a037ac. PMID:19531951.
- ^ Ng، J؛ Gosbell, IB؛ Kelly, JA؛ Boyle, MJ؛ Ferguson, JK (نوفمبر 2006). "Cure of multiresistant Acinetobacter baumannii central nervous system infections with intraventricular or intrathecal colistin: case series and literature review". The Journal of Antimicrobial Chemotherapy. ج. 58 ع. 5: 1078–81. DOI:10.1093/jac/dkl347. PMID:16916866.
- ^ Farrugia، DN؛ Elbourne, LD؛ Hassan, KA؛ Eijkelkamp, BA؛ Tetu, SG؛ Brown, MH؛ Shah, BS؛ Peleg, AY؛ Mabbutt, BC؛ Paulsen, IT (2013). "The Complete Genome and Phenome of a Community-Acquired Acinetobacter baumannii". PLoS ONE. ج. 8 ع. 3: e58628. Bibcode:2013PLoSO...858628F. DOI:10.1371/journal.pone.0058628. PMC:3602452. PMID:23527001.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Werneck، JS؛ Picão, RC؛ Carvalhaes, CG؛ Cardoso, JP؛ Gales, AC (فبراير 2011). "OXA-72-producing Acinetobacter baumannii in Brazil: a case report". The Journal of Antimicrobial Chemotherapy. ج. 66 ع. 2: 452–4. DOI:10.1093/jac/dkq462. PMID:21131320.
- ^ Martins، N؛ Martins, IS؛ de Freitas, WV؛ de Matos, JA؛ Magalhães, AC؛ Girão, VB؛ Dias, RC؛ de Souza, TC؛ Pellegrino, FL؛ Costa, LD؛ Boasquevisque, CH؛ Nouér, SA؛ Riley, LW؛ Santoro-Lopes, G؛ Moreira, BM (يونيو 2012). "Severe infection in a lung transplant recipient caused by donor-transmitted carbapenem-resistant Acinetobacter baumannii". Transplant Infectious Disease. ج. 14 ع. 3: 316–20. DOI:10.1111/j.1399-3062.2011.00701.x. PMC:3307813. PMID:22168176.
- ^ Superti، SV؛ Martins Dde, S؛ Caierão, J؛ Soares Fda, S؛ Prochnow, T؛ Zavascki, AP (مارس–أبريل 2009). "Indications of carbapenem resistance evolution through heteroresistance as an intermediate stage in Acinetobacter baumannii after carbapenem administration". Revista do Instituto de Medicina Tropical de Sao Paulo. ج. 51 ع. 2: 111–3. DOI:10.1590/s0036-46652009000200010. PMID:19390741.
- ^ Gionco، B؛ Pelayo, JS؛ Venancio, EJ؛ Cayô, R؛ Gales, AC؛ Carrara-Marroni, FE (أكتوبر 2012). "Detection of OXA-231, a new variant of blaOXA-143, in Acinetobacter baumannii from Brazil: a case report". The Journal of Antimicrobial Chemotherapy. ج. 67 ع. 10: 2531–2. DOI:10.1093/jac/dks223. PMID:22736746.
- ^ Zhao، WS؛ Liu, GY؛ Mi, ZH؛ Zhang, F (مارس 2011). "Coexistence of blaOXA-23 with armA and novel gyrA mutation in a pandrug-resistant Acinetobacter baumannii isolate from the blood of a patient with haematological disease in China". The Journal of Hospital Infection. ج. 77 ع. 3: 278–9. DOI:10.1016/j.jhin.2010.11.006. PMID:21281989.
- ^ Xiao، SC؛ Zhu, SH؛ Xia, ZF؛ Ma, B؛ Cheng, DS (نوفمبر 2009). "Successful treatment of a critical burn patient with obstinate hyperglycemia and septic shock from pan-drug-resistant strains". Medical Science Monitor. ج. 15 ع. 11: CS163–5. PMID:19865060.
- ^ Wu، YC؛ Hsieh, TC؛ Sun, SS؛ Wang, CH؛ Yen, KY؛ Lin, YY؛ Kao, CH (نوفمبر 2009). "Unexpected cloud-like lesion on gallium-67 scintigraphy: detection of subcutaneous abscess underneath the skin with normal appearance in a comatose patient in an intensive care setting". The American Journal of the Medical Sciences. ج. 338 ع. 5: 388. DOI:10.1097/maj.0b013e3181a6dd36. PMID:19770790.
- ^ Duan، X؛ Yang, L؛ Xia, P (مارس 2010). "Septic arthritis of the knee caused by antibiotic-resistant Acinetobacter baumannii in a gout patient: a rare case report". Archives of Orthopaedic and Trauma Surgery. ج. 130 ع. 3: 381–4. DOI:10.1007/s00402-009-0958-x. PMID:19707778.
- ^ أ ب Wagner, JA; Nenoff, P; Handrick, W; Renner, R; Simon, J; Treudler, R (Feb 2011). "Necrotizing fasciitis caused by Acinetobacter baumannii : A case report". Der Hautarzt; Zeitschrift für Dermatologie, Venerologie, und verwandte Gebiete (بالألمانية). 62 (2): 128–30. DOI:10.1007/s00105-010-1962-3. PMID:20835812.
- ^ Aivazova، V؛ Kainer, F؛ Friese, K؛ Mylonas, I (يناير 2010). "Acinetobacter baumannii infection during pregnancy and puerperium". Archives of Gynecology and Obstetrics. ج. 281 ع. 1: 171–4. DOI:10.1007/s00404-009-1107-z. PMID:19462176.
- ^ Schulte، B؛ Goerke, C؛ Weyrich, P؛ Gröbner, S؛ Bahrs, C؛ Wolz, C؛ Autenrieth, IB؛ Borgmann, S (ديسمبر 2005). "Clonal spread of meropenem-resistant Acinetobacter baumannii strains in hospitals in the Mediterranean region and transmission to South-west Germany". The Journal of Hospital Infection. ج. 61 ع. 4: 356–7. DOI:10.1016/j.jhin.2005.05.009. PMID:16213625.
- ^ Piparsania، S؛ Rajput, N؛ Bhatambare, G (سبتمبر–أكتوبر 2012). "Intraventricular polymyxin B for the treatment of neonatal meningo-ventriculitis caused by multi-resistant Acinetobacter baumannii--case report and review of literature". The Turkish Journal of Pediatrics. ج. 54 ع. 5: 548–54. PMID:23427525.
- ^ John، TM؛ Jacob, CN؛ Ittycheria, CC؛ George, AM؛ Jacob, AG؛ Subramaniyam, S؛ Puthiyaveettil, J؛ Jayaprakash, R (مارس 2012). "Macrophage activation syndrome following Acinetobacter baumannii sepsis". International Journal of Infectious Diseases. ج. 16 ع. 3: e223–4. DOI:10.1016/j.ijid.2011.12.002. PMID:22285540.
- ^ Sharma، A؛ Shariff, M؛ Thukral, SS؛ Shah, A (أكتوبر 2005). "Chronic community-acquired Acinetobacter pneumonia that responded slowly to rifampicin in the anti-tuberculous regime". The Journal of Infection. ج. 51 ع. 3: e149–52. DOI:10.1016/j.jinf.2004.12.003. PMID:16230195.
- ^ Jeong، HL؛ Yeom, JS؛ Park, JS؛ Seo, JH؛ Park, ES؛ Lim, JY؛ Park, CH؛ Woo, HO؛ Youn, HS (يوليو–أغسطس 2011). "Acinetobacter baumannii isolation in cerebrospinal fluid in a febrile neonate". The Turkish journal of Pediatrics. ج. 53 ع. 4: 445–7. PMID:21980849.
- ^ Hong، KB؛ Oh, HS؛ Song, JS؛ Lim, JH؛ Kang, DK؛ Son, IS؛ Park, JD؛ Kim, EC؛ Lee, HJ؛ Choi, EH (يوليو 2012). "Investigation and control of an outbreak of imipenem-resistant Acinetobacter baumannii Infection in a Pediatric Intensive Care Unit". The Pediatric Infectious Disease Journal. ج. 31 ع. 7: 685–90. DOI:10.1097/inf.0b013e318256f3e6. PMID:22466324.
- ^ Lee، YK؛ Kim, JK؛ Oh, SE؛ Lee, J؛ Noh, JW (ديسمبر 2009). "Successful antibiotic lock therapy in patients with refractory peritonitis". Clinical Nephrology. ج. 72 ع. 6: 488–91. DOI:10.5414/cnp72488. PMID:19954727.
- ^ Lee، SY؛ Lee, JW؛ Jeong, DC؛ Chung, SY؛ Chung, DS؛ Kang, JH (أغسطس 2008). "Multidrug-resistant Acinetobacter meningitis in a 3-year-old boy treated with i.v. colistin". Pediatrics International. ج. 50 ع. 4: 584–5. DOI:10.1111/j.1442-200x.2008.02677.x. PMID:18937759.
- ^ Adams، D؛ Yee, L؛ Rimmer, JA؛ Williams, R؛ Martin, H؛ Ovington, C (فبراير 2011). "Investigation and management of an A. Baumannii outbreak in ICU". British Journal of Nursing. ج. 20 ع. 3: 140, 142, 144–7. DOI:10.12968/bjon.2011.20.3.140. PMID:21378633.
- ^ Pencavel، TD؛ Singh-Ranger, G؛ Crinnion, JN (مايو 2006). "Conservative treatment of an early aortic graft infection due to Acinetobacter baumanii". Annals of Vascular Surgery. ج. 20 ع. 3: 415–7. DOI:10.1007/s10016-006-9030-2. PMID:16602028.
- ^ Gusten، WM؛ Hansen, EA؛ Cunha, BA (يناير–فبراير 2002). "Acinetobacter baumannii pseudomeningitis". Heart & Lung. ج. 31 ع. 1: 76–8. DOI:10.1067/mhl.2002.120258. PMID:11805753.
- ^ Fitzpatrick، MA؛ Esterly, JS؛ Postelnick, MJ؛ Sutton, SH (يوليو–أغسطس 2012). "Successful treatment of extensively drug-resistant Acinetobacter baumannii peritoneal dialysis peritonitis with intraperitoneal polymyxin B and ampicillin-sulbactam". Annals of Pharmacotherapy. ج. 46 ع. 7–8: e17. DOI:10.1345/aph.1r086. PMID:22811349.
- ^ Patel، JA؛ Pacheco, SM؛ Postelnick, M؛ Sutton, S (15 أغسطس 2011). "Prolonged triple therapy for persistent multidrug-resistant Acinetobacter baumannii ventriculitis". American Journal of Health-System Pharmacy. ج. 68 ع. 16: 1527–31. DOI:10.2146/ajhp100234. PMID:21817084.
- ^ Sullivan، DR؛ Shields, J؛ Netzer, G (يونيو 2010). "Fatal case of multi-drug resistant Acinetobacter baumannii necrotizing fasciitis". The American Surgeon. ج. 76 ع. 6: 651–3. PMID:20583528.
- ^ Tjoa E، Moehario LH، Rukmana A، Rohsiswatmo R (2013). "Acinetobacter baumannii: Role in Blood Stream Infection in Neonatal Unit, Cipto Mangunkusumo Hospital, Jakarta, Indonesia". International Journal of Microbiology. ج. 2013: 180763. DOI:10.1155/2013/180763. PMC:3830835. PMID:24288538.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link)
| Acinetobacter baumannii في المشاريع الشقيقة: | |
| |