هبتاكلور
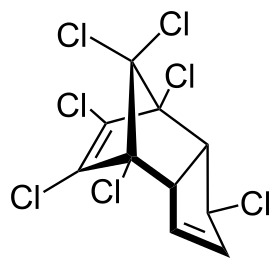
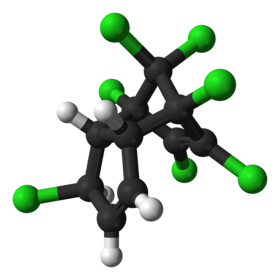
سباعي الكلور أو الهبتا كلور هو مركب كلور عضوي له الصيغة الجزيئية C10H5Cl7 ويستخدم كمبيد للحشرات. يُباع سباعي الكلور عادة على هيئة مسحوق أبيض أو أسمر اللون وله رائحة تشبه رائحة الكافور، وهو أحد المبيدات الحشرية التي تحتوي على السيكلودين.
| سباعي الكلور | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
1,4,5,6,7,8,8-Heptachloro-3a,4,7,7a-tetrahydro-1H-4,7-methanoindene |
|
| المعرفات | |
| رقم CAS | 68961-31-9 |
| بوب كيم (PubChem) | 3589 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | C10H5Cl7 |
| الكتلة المولية | 373.32 غرام/مول |
| المظهر | مسحوق أبيض أو أسمر اللون |
| الرائحة | له رائحة تشبه رائحة الكافور |
| الكثافة | 1.58 غرام/سم3 |
| نقطة الانصهار | 95 - 96 °س، 272 °ك، -46 °ف |
| نقطة الغليان | 135 - 145 °س، 263 °ك، -94 °ف |
| الذوبانية في الماء | 0.0006% (20 °C)[1] |
| ضغط البخار | 0.0003 mmHg (25 °C)[1] |
| المخاطر | |
| حد التعرض المسموح به U.S | TWA 0.5 مغم/متر3 [عن طريق الجلد][1] |
| LD50 | 116 مغم/كيلوغرام كتلة فمويا في حالة هنازير غينيا 40 مغم/كيلوغرام كتلة (فمويا في حالة الفئران) 100 مغم/كيلوغرام كتلة (فمويا في حالة الفئران) 68 mg/kg (فمويا في حالة الفئران) 100 مغم/كيلوغرام كتلة (فمويا في حالة الهامستر)[2] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
سباعي الكلور هو مركب قابل للذوبان في الأسيتون، والبنزين، ورباعي كلوريد الكربون، والهكسانون الحلقي.
شككت عالمة الأحياء البحرية والكاتبة العلمية الأمريكيّة راشيل كارسون في عام 1962 في كتابها الربيع الصامت في سلامة مُركّب سباعي الكلور وغيره من المبيدات الحشرية المكلورة. يمكن أن يظلّ سباعي الكلور في البيئة لعقود بفضل بنيته التركيبية عالية الثبات.
يقتصر بيع منتجات سباعي الكلور في الولايات المتحدة الأمريكية وفق ما حددته وكالة حماية البيئة الأمريكيّة على استخدامات محدودة مثل مكافحة النمل الناري في المحولات الأرضية، كما يتم تنظيم الكمية التي يمكن أن تكون موجودة في الأطعمة المختلفة.[3]
الخواص الكيميائيّة عدل
يساوي الوزن الجزيئي لسباعي الكلور 373.32 غرام/مول، ومعامل تقسيم الأوكتانول إلى ماء (Kow) لسباعي الكلور يساوي 105.27 تقريبًا، ويساوي ثابت قانون هنري له 2.3 · 10−3 ضغط جوي في المتر المكعب لكل مول، ويساوي ضغط بخار سباعي الكلوريد 3 · 10−4 عند 20 درجة مئوية.[4][5] تتراوح درجة حرارة انصحار سباعي الكلور ما بين 95 و96 درجة مئوية.
الإنتاج عدل
مثلما يحدث في تحضير السيكلودينات الأخرى، يتم إنتاج سباعي الكلور عن طريق تفاعل ديلز-ألدر لسداسي كلوريد البنتادايين الحلقي والبنتدايين الحلقي، ثم تتم كلورة ناتج التفاعل متبوعة بالمعالجة باستخدام كلوريد الهيدروجين في النيتروميثان في وجود ثلاثي كلوريد الألومنيوم أو أحادي كلوريد اليود.[6] يكون سباعي الكلور أكثر نشاطًا إذا ما قورن بالكلوردان بما يمقدار يتراوح ما بين 3 و5 مرات كمبيد حشري، ولكنه أكثر خمولًا كيميائيًا، لأنه مقاوم للماء والقلويات الكاوية.[6]
التمثيل الغذائي عدل
تقوم الكائنات الحية الدقيقة في التربة بتحويل سباعي الكلور عن طريق تفاعلات الإيبوكسدة والتحلل المائي والاختزال.[7]
الآثار البيئية عدل
يُعدّ مُركّب سباعي الكلور أحد الملوثات العضوية الثابتة (POP)، والتي لها فترة عمر نصف تتراوح ما بين 1.3-4.2 يومًا في الهواء، وما بين 0.03 و0.11 سنة في الماء، وما بين 0.11 و0.34 سنة في التربة.
وصفت إحدى الدراسات أن فترة عمر النصف الافتراضية لسباعي الكلور هي سنتان زاعمة أن بقاياها يمكن العثور عليها في التربة بعد 14 عامًا من تطبيقها الأولي. ومثل الملوثات العضوية الثابتة الأخرى، فإن سباعي الكلور هو مركب محب للدهون شحيح الذوبان في الماء (0.056 مجم/ لتر عند 25 درجة مئوية) ، وبالتالي فإنه يميل إلى التراكم في دهون جسم الإنسان والحيوان.
من المرجح أن يوجد إيبوكسيد سباعي الكلور في البيئة أكثر من المركب الأصلي. يذوب الإيبوكسيد أيضًا في الماء بسهولة أكبر من مركبه الأصلي ويكون أكثر ثباتًا. يمتص سباعي الكلور وإيبوكسيده جزيئات التربة ويتبخران.[8]
المراجع عدل
- ^ أ ب ت "NIOSH Pocket Guide to Chemical Hazards #0311". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ "Heptachlor". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH). 4 ديسمبر 2014. مؤرشف من الأصل في 2022-03-19. اطلع عليه بتاريخ 2015-03-27.
- ^ Robert L. Metcalf "Insect Control" in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. دُوِي:10.1002/14356007.a14_263
- ^ EPA, (2002). The Foundation for Global Action on Persistent Organic Pollutants: A United States Perspective https://books.google.com/books?id=m_7dqd3J9qoC&dq=The+Foundation+for+Global+Action+on+Persistent+Organic+Pollutants:A+United+States+Perspective&printsec=frontcover&source=bl&ots=sLJX57ijSm&sig=aSxxlJA-9PsTWUvpzrfz22mp-Hw&hl=en&ei=iyjaSficDpHMMqLe2KwL&sa=X&oi=book_result&ct=result&resnum=1 (Retrieved on April 06, 2009). نسخة محفوظة 2015-03-18 على موقع واي باك مشين.
- ^ Harmon, Katherine 2010 New Mass-Screening Method Finds Additional Environmental Risks for Diabetes. Scientific American, May 21, 2010.
- ^ أ ب Plimmer, J. R.، المحرر (2003). The Encyclopedia of Agrochemicals, Volume 3. New York: John Wiley & Sons.
- ^ California Environmental Protection Agency (1999). Public Health Goal for Heptachlor and Heptachlor Epoxide In Drinking Water - Office of Environment Health Hazard Assessment, California Environmental Protection Agency. "Archived copy" (PDF). مؤرشف من الأصل (PDF) في 2009-05-04. اطلع عليه بتاريخ 2013-12-19.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) (retrieved on April 04, 2009). - ^ ATSDR, (2007). Heptachlor and Heptachlor Epoxide - Fact Sheet [1]. نسخة محفوظة 2022-03-03 على موقع واي باك مشين.
| هبتاكلور في المشاريع الشقيقة: | |
| |