كبريتيد البيريليوم
كبريتيد البيريليوم (أو سلفيد البيريليوم) مركب كيميائي له الصيغة BeS، ويكوون على شكل بلورات بيضاء اللون.
| كبريتيد البيريليوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
Beryllium sulfide |
|
| أسماء أخرى | |
سلفيد البيريليوم |
|
| المعرفات | |
| رقم CAS | 13598-22-6 |
| بوب كيم (PubChem) | 83605 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | BeS |
| الكتلة المولية | 41.08 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 2.36 غ/سم3 |
| نقطة الانصهار | 1800 °س يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
التحضير عدل
يحضّر كبريتيد البيريليوم من التفاعل المباشر لعنصري الكبريت والبيريليوم عند 1150 °س.
كما يحضر المركب بطريقة أخرى من تفاعل كلوريد البيريليوم مع كبريتيد الهيدروجين، كما في التفاعل التالي:
لكن الطريقة الأخيرة تعطي ناتجاً من كبريتيد البيريليوم يحوي آثاراً من الكلوريد.
من الطرق الأخرى لتحضير المركب اختزال كبريتات البيريليوم، أو تفاعل أكسيد البيريليوم مع ثنائي كبريتيد الكربون.[2]
الخواص عدل
إن كبريتيد البيريليوم عبارة عن مادة بلورية صلبة لها لون أبيض، أحياناً رمادي، لها رائحة خفيفة تشبه كبريتيد الهيدروجين. يتحلمه المركب ببطء، ويتفكك بسرعة تحت تأثير الأحماض وغاز ثنائي أكسيد الكربون.[3]
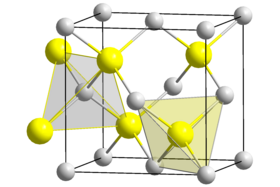
يتبلور BeS وفق النظام البلّوري المكعّب ببنية تشبه بنية السفاليريت، ويكون ثابت الشبكة البلورية مقداره 485 بيكومتر،[2] وتتبع البلورة الزمرة الفراغية من النمط [4]
لكبريتيد البيريليوم خصائص شبه موصل غير مباشرة، حيث أن فجوة النطاق المباشرة لها قيمة تبلغ 7.4 ميغا إلكترون فولت، وغير المباشرة 4.7 ميغا إلكترون فولت.[4]
احتياطات الأمان عدل
إن البيريليوم ومركباته الكيميائية هي مواد سامّة ومسرطنة، حيث يمكن أن تسبب مرض التسمم بالبيريليوم. لذا ينبغي أخذ الحيطة والحذر عند التعامل مع هذه المركبات.
المراجع عدل
- ^ https://pubchem.ncbi.nlm.nih.gov/compound/83605. اطلع عليه بتاريخ 2018-04.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة)، الوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة)، وتحقق من التاريخ في:|accessdate=(مساعدة) - ^ أ ب Brauer، Georg (1975)، Handbuch der Präparativen Anorganischen Chemie (ط. 3rd)، Stuttgart: Enke، ص. 890، ISBN:3-432-02328-6(بالألمانية)
- ^ Walsh، Kenneth (2009)، Beryllium Chemistry and Processing، ASM International، ص. 127، ISBN:0871707217
- ^ أ ب Ropp، Richard (2012)، Encyclopedia of the Alkaline Earth Compounds، Newnes، ص. 137، ISBN:0444595538