بليريكسافور
هذه مقالة غير مراجعة. (أكتوبر 2021) |
بليريكسافور( INN وأوسان ، الاسم التجاري موزوبيل ) هو محفز المناعة يستخدم لتحريك واخراج الخلايا الجذعية المكونة للدم في مرضى السرطان من نخاع العظم إلى مجرى الدم. ثم يتم استخراج الخلايا الجذعية من الدم وزرعها مرة أخرى للمريض. تم تطوير العقار بواسطة AnorMED ، والذي تم شراؤه لاحقًا بواسطة Genzyme .
| بليريكسافور | |
|---|---|
| الاسم النظامي | |
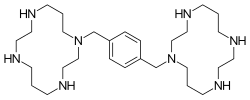
| 1,1’-(1,4-phenylenebismethylene)bis(1,4,8,11- tetraazacyclotetradecane) | |
| يعالج | |
| اعتبارات علاجية | |
| اسم تجاري | موزوبيل |
| مرادفات | JM 3100, AMD3100 |
| ASHPDrugs.com | أفرودة |
| مدلاين بلس | a609018 |
| الوضع القانوني | وكالة الأدوية الأوروبية:وصلة، ديلي مد:وصلة |
| فئة السلامة أثناء الحمل | D (أستراليا) D (الولايات المتحدة) D |
| طرق إعطاء الدواء | تحت الجلد |
| بيانات دوائية | |
| ربط بروتيني | تصل إلى 58% |
| استقلاب (أيض) الدواء | لا يوجد |
| عمر النصف الحيوي | من 3-5 ساعات |
| إخراج (فسلجة) | عن طريق الكلى |
| معرّفات | |
| CAS | 110078-46-1 |
| ك ع ت | L03L03AX16 AX16 |
| بوب كيم | CID 65015 |
| IUPHAR | 844 |
| درغ بنك | DB06809 |
| كيم سبايدر | 58531 |
| المكون الفريد | S915P5499N |
| كيوتو | D08971 |
| ChEBI | CHEBI:125354 |
| ChEMBL | CHEMBL18442 |
| ترادف | JM 3100, AMD3100 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C28H54N8 |
| تعديل مصدري - تعديل | |
الاستخدامات الطبية عدل
يستخدم هذا الدواء لاخراج الخلايا الجعية من نخاع العظم إلى مجرى الدم المحيطي، وهو أمر مهم كمصدر للخلايا الجذعية المكونة للدم من أجل الزرع ، عملية إخراج الخلايا الجذعية إلى مجرى الدم تتم من خلال استخدام عامل تحفيز مستعمرة الخلايا الحبيبية (G-CSF) ، ولكنه غير فعال في حوالي 15 إلى 20٪ من المرضى. ان الجمع بين G-CSF مع بليريكسافور يزيد من فرص إخراج الخلايا الجذعية من نخاع العظم إلى مجرى الدم وبالتالي توفير خلايا جذعية كافية للزرع.[2] تمت الموافقة على الدواء لمرضى سرطان الغدد الليمفاوية والورم النخاعي المتعدد .[3]
موانع الاستخدام عدل
الحمل والرضاعة عدل
أظهرت الدراسات التي أجريت على الحيوانات الحوامل تأثيرات مشوهه للأجنة. ولذلك يمنع استخدام بليريكسافور في النساء الحوامل إلا في الحالات الحرجة. يجب استخدام وسائل منع الحمل في النساء الخصبات (المعرضة للحمل) اثناء استخدام العلاج . من غير المعروف ما إذا كان الدواء يفرز في حليب الأم ام لا لذلك يجب التوقف عن الرضاعة الطبيعية أثناء فترة العلاج.[3]
الآثار السلبية عدل
الغثيان والإسهال والتفاعلات الموضعية لوحظت في أكثر من 10٪ من المرضى. مشاكل أخرى في الهضم وأعراض عامة مثل الدوخة والصداع وآلام العضلات شائعة نسبيًا حيث ظهرت في أكثر من 1 ٪ من المرضى. حدث تحسس من استخدام العلاج في أقل من 1٪ من الحالات. كانت اغلب الآثار السلبية في التجارب السريرية خفيفة وعابرة.[3][4]
أدرجت وكالة الأدوية الأوروبية عددًا من مخاوف السلامة ليتم تقييمها على أساس ما بعد التسويق، وأبرزها الاحتمالات النظرية هي تمزق الطحال و تحريك الخلايا السرطانية إلى مجرى الدم. لقد أثير القلق الأول لأنه لوحظ تضخم الطحال في الحيوانات اثناء دراسة الاثار السلبية عليها، بالإضافة إلى ان علاج ال G-CSF تسبب في تمزق الطحال في حالات نادرة.انتقلت الخلايا السرطانية من اماكن تواجدها في العظم إلى مجرى الدم في مرضى سرطان الدم الذين عولجوا بليريكسافور من قبل.[5]
التداخلات الدوائية عدل
لم يتم إجراء دراسات كافية لتوضيح احتمالية وجود تداخلات دوائية مع الادوية الأخرى. ربما احتمالية وجود تداخلات دوائية مع الادوية الأخرى قليلة بحكم دواء بليركسافور لا يتأين ولا يرتبط مع السايتوكروم.[6]
علم الأدوية عدل
آلية عمل الدواء عدل
ان دواء البريلكسافور في شكله المرتبط مع الزنك يعمل على تثبيط وغلق (أو ربما أكثر دقة غلق جزئي) مستقبلات ألفا chemokine CXCR4 و منشط خفي من CXCR7 .[7] يعتبر مستقبل CXCR4 الفا- chemokine وأحد روابطه ، SDF-1 ، مهمين في ربط الخلايا الجذعية المكونة للدم مع نخاع العظم وفي سكون الخلايا الجذعية المكونة للدم . ان تأثير دواء البليركسافور في جسم الكائن الحي فيما يتعلق بـ يوبيكويتين ، جزيء الداخلي البديل لـ CXCR4 ، غير معروف. تم العثور على بليركسافور ليكون محفزًا قويًا لتحريك الخلايا الجذعية المكونة للدم من نخاع العظام إلى مجرى الدم كخلايا جذعية للدم المحيطي .[8] بالإضافة إلى ذلك، يمنع دواء البليركسافور من تعبير CD20 على الخلايا B عن طريق التداخل مع محور CXCR4 / SDF1 الذي ينظم تعبيره.
حركية الدواء عدل
يتم امتصاص دواء البليركسافور بشكل سريع بعد حقن الدواء تحت الجلد، حيث تصل اعلى تراكيز من الدواء خلال فترة من 30 إلى 60 دقيقة. يرتبط ما يقارب إلى 58٪ من الدواء مع بروتينات البلازما، بينما يتواد الباقي في الغالب في خارج الأوعية الدموية . لا يتأين الدواء بكميات كبيرة. لا يتداخل الدواء مع إنزيمات السيتوكروم P450 أو الكلايكوبروتين . يصل تركيز الدواء في الدم إلى النصف خلال فترة من 3 إلى 5 ساعات. يتم طرخ دواء البليركسافور إلى خارج الجسم عن طريق الكلى. ويُطرح 70٪ من الدواء في غضون 24 ساعة.[6]
كيميائية الدواء عدل
بليركسافور هو مركب حلقي كبير ومشتق ثنائي السيكلام، حلقات السيكلام مرتبطة عن طريق ذرات النيتروجين الأميني بواسطة فاصل 1.4- زيل.[9] بليركسافور قاعدة قوية. جميع ذرات النيتروجين الثمانية تقبل البروتونات بسهولة. تشكل الحلقتان كبيرتان الحلقتان معقدات مخلبة مع أيونات معدنية ثنائية التكافؤ، خاصة الزنك والنحاس والنيكل ، وكذلك الكوبالت والروديوم . الشكل النشط بيولوجيًا لـدواء البليركسافور هو مركب الزنك.[10]
التصنيع عدل
ثلاث من أربع ذرات نيتروجين في دورة الماكرو سيكلام ... (1,4,8,11-رباعي أسيكلوتيتراديكان) محمية بمجموعات التوسيل. تمت معالجة المنتج بـ 1,4-bis (brommethyl) benzene and potassium carbonate in acetonitrile . بعد شق مجموعات tosyl بحمض الهيدروبروميك ، يتم الحصول على اوكتاهيدوبرومايد البليركسافور.
تاريخ عدل
تم تصنيع هذا الجزيء لأول مرة في عام 1987 لإجراء دراسات أساسية حول كيمياء الأكسدة والاختزال لمركبات التنسيق ثنائي الفلزات.[11] بعد ذلك، اكتشف كيميائي آخر بالصدفة أن مثل هذا الجزيء يمكن أن يكون له استخدام محتمل في علاج فيروس نقص المناعة البشرية بسبب دوره في منع CXCR4 ، وهو مستقبل كيميائي يعمل كمستقبل مشترك لسلالات معينة من فيروس نقص المناعة البشرية (على طول مع المستقبل الخلوي الرئيسي للفيروس، CD4).[12] تم إنهاء تطوير هذا الوصف بسبب توافر الدواء بتراكيز قليلة عن اعطائة الفموي والاضطرابات القلبية. إجراء المزيد من الدراسات ادى إلى الوصف الجديد لمرضى السرطان.[12]
المجتمع والثقافة عدل
البلكسافور من الادوية الفريدة في الولايات المتحدة والاتحاد الأوروبي التي تستخدم لتحريك الخلايا الجذعية المكونة للدم من نخاع العظم . وافقت إدارة الغذاء والدواء الأمريكية (FDA) على استخدام الدواء لهذا الوصف في 15 ديسمبر 2008.[13] في الاتحاد الأوروبي، تمت الموافقة على الدواء بعد تقرير تقييم إيجابي للجنة المنتجات الطبية للاستخدام البشري في 29 مايو 2009.[14] تمت الموافقة على الدواء للاستخدام في كندا من قبل وزارة الصحة الكندية في الثامن من ديسمبر 2011.[15]
الابحاث عدل
الخصائص المضادة للسرطان عدل
لوحظ أن دواء البليركسافور يقلل من حركة وانتقال الورم الخبيث في الفئران في العديد من الدراسات.[16] كما ثبت أنه يقلل من تكرار الورم الأرومي الدبقي في الفئران بعد العلاج الإشعاعي. في هذا النموذج، اعتمدت الخلايا السرطانية التي نجت من الإشعاع بشكل حاسم على الخلايا المشتقة من نخاع العظام لتكوين الأوعية الدموية، وتم توظيف هذا الأخير بوساطة تفاعلات SDF-1 CXCR4 ، والتي تم منعها بواسطة دواء البليكسافور.[17]
استخدم في أبحاث الخلايا الجذعية عدل
أظهر الباحثون في كلية إمبريال أن بلريكسافور بالاشتراك مع عامل نمو بطانة الأوعية الدموية (VEGF) يمكن أن يحرك الخلايا الجذعية الوسيطة وخلايا السلف البطانية في الدم المحيطي للفئران.[18]
في تجربة عشوائية مزدوجة التعمية ومحكومة بالدواء الوهمي، لم يحسن تحريك الخلايا الجذعية باستخدام البليركسافور التئام جروح السكري .[19]
العصبية عدل
تم ايقاف إشارات CXCR4 بواسطة بليركسافور بشكل غير متوقع أيضًا ليكون فعالًا في مواجهة فرط التألم الناجم عن المواد الأفيونية الناتجة عن العلاج المزمن بالمورفين ، على الرغم من إجراء الدراسات على الحيوانات فقط حتى الآن.[20]
المراجع عدل
- ^ Drug Indications Extracted from FAERS، DOI:10.5281/ZENODO.1435999، QID:Q56863002
- ^ "Plerixafor". Drugs in R&D. ج. 8 ع. 2: 113–119. 2007. DOI:10.2165/00126839-200708020-00006. PMID:17324009.
- ^ أ ب ت Haberfeld, H, ed. (2009). Austria-Codex (بالألمانية) (2009/2010 ed.). Vienna: Österreichischer Apothekerverlag. ISBN:978-3-85200-196-8.
- ^ Wagstaff، A. J. (2009). "Plerixafor: in patients with non-Hodgkin's lymphoma or multiple myeloma". Drugs. ج. 69 ع. 3: 319–26. DOI:10.2165/00003495-200969030-00007. PMID:19275275.
- ^ "CHMP Assessment Report for Mozobil" (PDF). وكالة الأدوية الأوروبية. مؤرشف من الأصل (PDF) في 2018-06-18.
- ^ أ ب Haberfeld, H, ed. (2009). Austria-Codex (بالألمانية) (2009/2010 ed.). Vienna: Österreichischer Apothekerverlag. ISBN:978-3-85200-196-8.Haberfeld, H, ed. (2009). Austria-Codex (in German) (2009/2010 ed.). Vienna: Österreichischer Apothekerverlag. ISBN 978-3-85200-196-8.
- ^ Kalatskaya، I.؛ Berchiche، Y. A.؛ Gravel، S.؛ Limberg، B. J.؛ Rosenbaum، J. S.؛ Heveker، N. (2009). "AMD3100 is a CXCR7 Ligand with Allosteric Agonist Properties". Molecular Pharmacology. ج. 75 ع. 5: 1240–7. DOI:10.1124/mol.108.053389. PMID:19255243.
- ^ Cashen، A. F.؛ Nervi، B.؛ Dipersio، J. (2007). "AMD3100: CXCR4 antagonist and rapid stem cell-mobilizing agent". Future Oncology. ج. 3 ع. 1: 19–27. DOI:10.2217/14796694.3.1.19. PMID:17280498.
- ^ "Plerixafor". Drugs in R&D. ج. 8 ع. 2: 113–119. 2007. DOI:10.2165/00126839-200708020-00006. PMID:17324009."Plerixafor". Drugs in R&D. 8 (2): 113–119. 2007. doi:10.2165/00126839-200708020-00006. PMID 17324009.
- ^ Esté، J. A.؛ Cabrera، C.؛ De Clercq، E.؛ Struyf، S.؛ Van Damme، J.؛ Bridger، G.؛ Skerlj، R. T.؛ Abrams، M. J.؛ Henson، G. (1999). "Activity of different bicyclam derivatives against human immunodeficiency virus depends on their interaction with the CXCR4 chemokine receptor". Molecular Pharmacology. ج. 55 ع. 1: 67–73. DOI:10.1124/mol.55.1.67. PMID:9882699.
- ^ Ciampolini، M.؛ Fabbrizzi، L.؛ Perotti، A.؛ Poggi، A.؛ Seghi، B.؛ Zanobini، F. (1987). "Dinickel and dicopper complexes with N,N-linked bis(cyclam) ligands. An ideal system for the investigation of electrostatic effects on the redox behavior of pairs of metal ions". Inorganic Chemistry. ج. 26 ع. 21: 3527–3533. DOI:10.1021/ic00268a022.
- ^ أ ب Davies، S. L.؛ Serradell، N.؛ Bolós، J.؛ Bayés، M. (2007). "Plerixafor Hydrochloride". Drugs of the Future. ج. 32 ع. 2: 123. DOI:10.1358/dof.2007.032.02.1071897.
- ^ "Mozobil approved for non-Hodgkin's lymphoma and multiple myeloma" (Press release). Monthly Prescribing Reference. 18 ديسمبر 2008. مؤرشف من الأصل في 2009-01-06. اطلع عليه بتاريخ 2009-01-03.
- ^ "CHMP Assessment Report for Mozobil" (PDF). وكالة الأدوية الأوروبية. مؤرشف من الأصل (PDF) في 2018-06-18. اطلع عليه بتاريخ 2021-10-09."CHMP Assessment Report for Mozobil" نسخة محفوظة 18 يونيو 2018 على موقع واي باك مشين. (PDF). European Medicines Agency.
- ^ Notice of Compliance information نسخة محفوظة 10 أكتوبر 2021 على موقع واي باك مشين.
- ^ Smith، M. C. P.؛ Luker، K. E.؛ Garbow، J. R.؛ Prior، J. L.؛ Jackson، E.؛ Piwnica-Worms، D.؛ Luker، G. D. (2004). "CXCR4 Regulates Growth of Both Primary and Metastatic Breast Cancer". Cancer Research. ج. 64 ع. 23: 8604–8612. DOI:10.1158/0008-5472.CAN-04-1844. PMID:15574767.
- ^ Kioi، M.؛ Vogel، H.؛ Schultz، G.؛ Hoffman، R. M.؛ Harsh، G. R.؛ Brown، J. M. (2010). "Inhibition of vasculogenesis, but not angiogenesis, prevents the recurrence of glioblastoma after irradiation in mice". Journal of Clinical Investigation. ج. 120 ع. 3: 694–705. DOI:10.1172/JCI40283. PMID:20179352.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Pitchford، S.؛ Furze، R.؛ Jones، C.؛ Wengner، A.؛ Rankin، S. (2009). "Differential Mobilization of Subsets of Progenitor Cells from the Bone Marrow". Cell Stem Cell. ج. 4 ع. 1: 62–72. DOI:10.1016/j.stem.2008.10.017. PMID:19128793.
- ^ Bonora، Benedetta Maria؛ Cappellari، Roberta؛ Mazzucato، Marta؛ Rigato، Mauro؛ Grasso، Marco؛ Menegolo، Mirko؛ Bruttocao، Andrea؛ Avogaro، Angelo؛ Fadini، Gian Paolo (2020). "Stem cell mobilization with plerixafor and healing of diabetic ischemic wounds: A phase IIA, randomized, double‐blind, placebo‐controlled trial". Stem Cells Translational Medicine. ج. 9 ع. 9: 965–973. DOI:10.1002/sctm.20-0020. PMID:32485785.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "CXCR4 Signaling Mediates Morphine-induced Tactile Hyperalgesia". Brain, Behavior, and Immunity. ج. 25 ع. 3: 565–73. مارس 2011. DOI:10.1016/j.bbi.2010.12.014. PMID:21193025.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)
روابط خارجية عدل
- "Plerixafor". Drug Information Portal. U.S. National Library of Medicine.
- MeSH JM +3100
| بليريكسافور في المشاريع الشقيقة: | |
| |